铁及其化合物在生产生活中有广泛应用。一、铁的有关知识(1)明代科学著作《天工开物》记载了中国劳动人民的科技成就。①“或用木炭,扇炉风箱,土(铁矿石)化成铁”描述
常见的金属元素有铁、铜、铝,广泛应用于建筑和工业生产中。 #生活百科# #百科知识#
题型:综合应用题 难度:0.15 引用次数:579 题号:21211535
铁及其化合物在生产生活中有广泛应用。
一、铁的有关知识
(1)明代科学著作《天工开物》记载了中国劳动人民的科技成就。
① “或用木炭,扇炉风箱,土(铁矿石)化成铁”描述了古代炼铁的方法。用化学方程式表示赤铁矿炼铁的原理:
。
②对生铁炼钢的描述:“凡钢铁炼法,火力到时生铁先化”,说明生铁的熔点比钢
。
③ “烧铁器淬于胆矶水(硫酸铜溶液)中,即成铜色也”,其中蕴含的化学反应方程式是
。
(2)铁器表面通过化学方法可形成致密的Fe3O4保护膜,其组成可用 FeO·Fe2O3表示。故宫博物院对某出土铁器保护的过程如下。
① 检测锈蚀产物
主要成分
Fe3O4Fe2O3·H2OFeOOH
FeOCl说明铁器在含有O2、
____和盐等环境中容易被腐蚀。
② 化学修复出土铁器可通过脱氯、还原,形成保护层来实现,原理如下:

还原时铁元素的化合价
____(填“部分”“全部”或“没有”)降低。
二、催化剂 Fe3O4的制备
Fe3O4是合成氨催化剂的主要成分。用铁泥(主要成分为 Fe2O3、FeO,含少量Fe)制备Fe3O4的主要流程如下。
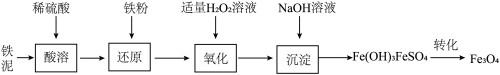
(3)加入H2O2将部分FeSO4转化为Fe2(SO4)3。“氧化”时温度不宜太高,原因是
___。
三、失效催化剂的再生
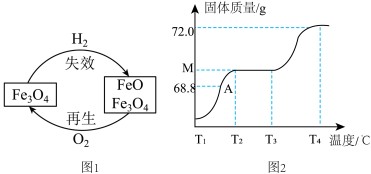
(4)合成氨催化过程中因部分Fe3O4与H2反应使催化剂“失效”。在一定温度下可用O2将其“再生”,原理如图1所示。“再生”过程中铁元素的质量分数
____(填“变大” “不变”或 “变小”)。
(5)通入O2加热,将一定质量失效催化剂进行再生。固体质量与温度变化的关系如图2所示。T1℃-T2℃下,FeO转化为Fe3O4,T3℃-T4℃下,Fe3O4转化为Fe2O3。则M=
g。
更新时间:2023/12/23 19:02:12 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐综合应用题 | 困难 (0.15)
解题方法
【推荐1】NaCl是一种重要的化工原料。
(1)粗盐中含可溶性CaCl2、MgCl2等杂质。学习小组设计了如下方案提纯粗盐: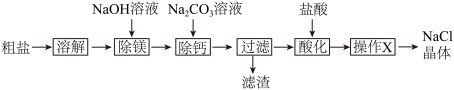
①“滤渣”中含有
(填化学式)。
②“操作X”的名称为
。
(2)以NaCl和NH4HCO3为原料可制备另一种重要的化工原料Na2CO3。
步骤1 称取一定质量的NaCl,加水溶解。
步骤2 向其中加入一定质量的NH4HCO3,充分反应。
步骤3 过滤、洗涤、干燥、加热可得Na2CO3。
已知:NaHCO3受热易分解:2NaHCO3Na2CO3+H2O+CO2↑。
相关物质的溶解度曲线如图所示。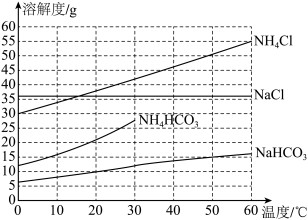
①步骤2中反应的化学方程式为
。
②图10中碳酸氢铵溶解度在30 ℃后无数据的原因可能是
。
(3)为了分析上述所制得的Na2CO3晶体中是否含有NaHCO3,取晶体进行如下实验:
Ⅰ定性分析
称取m1 g 晶体,利用如图装置(夹持仪器略)分析晶体的成分。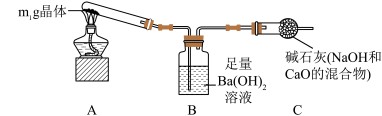
①反应一段时间后,能说明晶体中含有NaHCO3的现象为
。
②将晶体加热至残留固体的质量不再改变,测得残留固体的质量为m2 g。若1∶1<m1∶m2 <
,也能说明晶体中含有NaHCO3。
③甲同学认为通过测定装置B中沉淀的质量,即可确定晶体的组成。请对甲同学的观点进行评价:
。
Ⅱ定量分析
步骤1:取2.500 g晶体于锥形瓶中,加水使样品完全溶解。向锥形瓶中逐滴滴加溶质质量分数为1%的稀盐酸,当Na2CO3恰好完全转化为NaHCO3时,发生反应的化学方程式为:Na2CO3+HCl=NaHCO3+NaCl,反应消耗稀盐酸83.19 g。
步骤2:向步骤1所得的溶液中继续逐滴滴加溶质质量分数为1%的稀盐酸,至NaHCO3恰好完全反应时,发生反应的化学方程式为:NaHCO3+HCl=NaCl+H2O+CO2↑,又消耗稀盐酸86.84 g。
④晶体中NaHCO3的质量分数为
(写出计算过程)。
⑤乙同学认为做完步骤1即可确定晶体的组成。请对乙同学的观点进行评价:
。
2022/05/27 | 447次组卷
综合应用题 | 困难 (0.15)
解题方法
【推荐2】铁及其化合物在生活、生产中应用广泛。
(一)铁的相关知识
(1)用铁锅烹煮食物,说明铁具有
性;
(2)世卫组织曾多次推荐中国的铁锅作为烹饪用具,铁锅相对于其它烹饪用具的优势是
。
(3)由生铁制成的铁锅初次使用前,需“烤蓝”处理,即高温烈焰使其表面形成致密的Fe3O4膜,该层膜隔绝了铁与空气中的
接触,以防生锈;
(4)铁锈蚀的原理: 写出Fe(OH)2转化为Fe(OH)3的化学方程式
。
(5)工业上,常用稀HCl去除铁锈(用Fe2O3·xH2O表示),其反应的化学方程式是
。
(二)氯化铁晶体(FeCl3﹒nH2O)的制备
以工业烧渣(含Fe2O3、FeO及少量二氧化硅)为原料生产氯化铁晶体的流程如下:
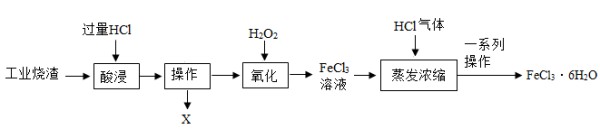
资料:FeCl3溶液在加热条件下易转化为Fe(OH)3,在HCl气体的保护下能阻止此转化的发生。
(6)X的化学式是
。
(7)“氧化”中,加入H2O2是将酸性条件下的+2价铁转化为+3价的铁,该反应的化学方程式是
。
(8)FeC13溶液中含有盐酸,不会影响氯化铁晶体纯度,其理由是
。
(9)“一系列操作”含…、洗涤、晾干,洗涤时为减少晶体损失,最好选用
(选填序号)。
a.冷水 b.热水 c.95%的乙醇溶液
(三)氯化铁晶体的热重分析
经科研人员测定,以上得到的是FeCl3﹒nH2O和Fe(OH)3的混合物。称取该混合物样品64.8g,用以下装置进行热分解实验。
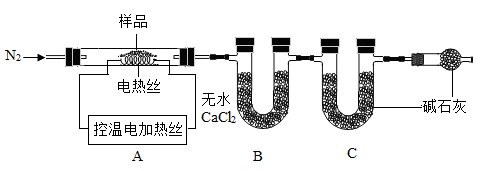
已知:Mr(FeCl3)=162.5、Mr(Fe(OH)3)=107
【资料】
①氯化铁晶体在120℃开始分解,生成Fe(OH)3、H2O、HCl,200℃分解完全;
②在220℃时,Fe(OH)3开始分解为Fe2O3,500℃时分解完全;
③无水CaC12作为干燥剂,不吸收HCl。
(10)装配好实验装置后,要先
。
(11)加热前后均需通入N2,加热后通N2的目的是
。
温度/℃室温500B装置/g200.0218.9C装置/g200.0221.9(12)加热玻璃管,测得500℃时B、C的质量变化如上表,玻璃管内剩余固体的质量为24.0g。
①样品中铁元素的质量为
g;
②n=
。
(13)实验结束,不改变原有装置,将N2改为通入CO,对24.0g剩余固体继续加热一段时间,冷却,得到黑色粉末20.0g,该黑色粉末的成分是
。
2022/06/30 | 592次组卷
综合应用题 | 困难 (0.15)
解题方法
【推荐3】碳酸钠在生活和生产中都有广泛的应用。为探究碳酸钠的相关知识,同学们做了如下实验。请根据实验回答问题:
探究实验一、有关碳酸钠的化学性质(已知氯化钙溶液呈中性)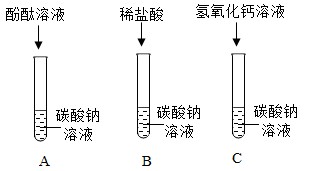
(1)A试管中溶液变成红色,说明碳酸钠溶液显
性。
(2)B试管中观察到的实验现象
,说明碳酸钠能与盐酸反应。
(3)C试管中有白色沉淀产生,写出该反应的化学方程式
。
(4)实验结束后,同学们将三支试管中的物质倒入同一个洁净的烧杯中,静置一段时间后,观察到烧杯底部有白色沉淀,上层溶液为无色。
【提出问题】无色溶液中除酚酞外还有哪些溶质?
【分析讨论】无色溶液中一定含有的溶质是
(填化学式,下同),可能含有的溶质是
______。
【实验验证】为检验无色溶液中可能含有的溶质是否存在,可选用
(填数字序号)进行检验。
①石蕊溶液 ②硝酸银溶液 ③碳酸钠溶液 ④稀盐酸
探究实验二、有关碳酸钠的制取
下图是同学们在实验室模拟“侯氏制碱法”生产碳酸钠(纯碱)的工艺流程图。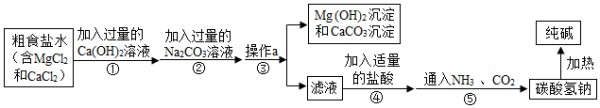
(5)“侯氏制碱法”中的侯氏指的是我国制碱专家
。
(6)操作a中用到的主要玻璃仪器有哪些?
(写3种)。
(7)滤液中除NaCl外,还有其他溶质,请设计实验证明。(简要写出实验步骤、现象和结论)
。
(8)步骤⑤是向饱和NaCl溶液中通入足量的NH3和CO2,反应最终得到小苏打(在该溶液中会析出部分固体)和氯化铵,写出该反应的化学方程式
。
探究实验三、有关碳酸钠含量的测定
工业上制得的纯碱,可能含有NaHCO3和NaCl中的一种或两种杂质,为了确定其成分,进行如下实验探究,实验装置(气密性良好)和主要的实验步骤如下(碱石灰是氢氧化钠和生石灰的固体混合物)。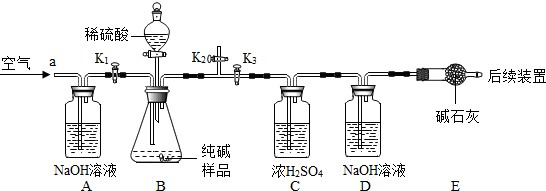
①称量D装置质量为200g,将10.6g纯碱样品放入锥形瓶中,按上图组装后进行实验操作甲,然后缓缓鼓入一段时间空气;
②再次对活塞进行实验操作,然后加入足量稀硫酸,待锥形瓶中不再产生气泡时,再次打开止水夹K1,从导管a处再次缓缓鼓入空气;
③一段时间后再次称量装置D,装置总质量为204.84g。
回答下列问题:
(9)步骤①中进行的实验操作甲是______(填序号)。
(10)装置D中发生反应的化学方程式是
______。
(11)装置E的作用是
。
(12)通过计算,可以判断纯碱样品中
含NaHCO3(填“一定、“一定不”或“可能”)。
(13)原样品中碳元素的质量为
g。
2023/05/09 | 455次组卷
网址:铁及其化合物在生产生活中有广泛应用。一、铁的有关知识(1)明代科学著作《天工开物》记载了中国劳动人民的科技成就。①“或用木炭,扇炉风箱,土(铁矿石)化成铁”描述 https://www.yuejiaxmz.com/news/view/1047247
相关内容
铁及其化合物在日常生活、生产中应用广泛.(1)某温度下,Ksp(FeS)=8.1×10磁铁在生活中有哪些作用
铁及其化合物在日常生活、生产中应用广泛,研究铁及其化合物的应用意义重大.请回答下列问题:(1)已知高炉炼铁过程中会发生如下反应:FeO(s)+CO(g)⇌Fe(s)+CO2(g)K1△H1=a
铜和铁是生产、生活中广泛使用的金属.(1)工业上用一氧化碳和赤铁矿(主要成分是氧化铁)冶炼铁,反应的化学方程式为:3CO+Fe2O3高温.2Fe+3CO23CO+Fe2O3高温.2Fe+3CO2.(2)铁生锈的条
铁及其化合物在生活、生产中有广泛应用.请回答下列问题:(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:3FeS2+8O2高温.6SO2+Fe3O4,有3molFeS2参加反应,转
铁和铁的化合物在工业生产和日常生活中都有广泛的用途.(1)在定向爆破中.常利用氧化铁与铝反应放出的热量来切割钢筋.该反应的化学方程式为__.(2)已知:2Fe2O3=3CO2 △H=+468.2 kJ·mol
铁及其化合物在生产、生活中有广泛应用。请回答下列问题:(1)水热法制备Fe3O4纳米颗粒的反应是:3Fe2++2S2O32
从一块冰箱面板看钢铁制造供应链 中国“链”接世界 打造全球合作“共赢链”
铁及其化合物在日常生活.生产中应用广泛.氯化铁和高铁酸钾都是常见的水处理剂.如图为制备氯化铁及进一步氧化制备高铁酸钾的工艺流程.请回答下列问题:(1)已知:①Fe2O3+3CO(g)△H=+489.0kJ•mol
泽州铁器:不是铸铁那么简单

