含8克NaOH的溶液中通入一定量的H2S气体后.可发生以下反应:NaOH+H2S=NaHS+H2O.2NaOH+H2S=Na2S+2H2O.将得到的溶液小心蒸干.称得无水固体7.9g.则该固体中一定含有的物质是( ) A.Na2S B.NaHS C.Na2S和NaHS D.Na2S和NaOH 题目和参考答案——青夏教育精英家教网——
混合液体和固体时,先将固体放入杯中,再加液体,以免溅出。 #生活技巧# #家电使用技巧# #搅拌机使用技巧#
【考点】根据化学反应方程式的计算.
【专题】混合物组成的判断.
【分析】(1)注意反应顺序:NaOH先和H2S反应生成NaHS,若NaOH还有剩余,则NaOH继续和NaHS反应生成Na2S;
(2)反应产物分三种情况进行讨论:
①NaOH少量,产物只有NaHS;
②NaOH和H2S反应生成NaHS后还有剩余,产物是NaHS和Na2S的混合物;
③NaOH和NaHS反应完后还过量,产物是NaOH和Na2S的混合物.
(3)利用极值法判断产物的类型.
【解答】解:①若NaOH少量,则产物只有NaHS,那么固体质量应该增加,而实际固体质量在减小,因此不可能是NaOH少量;
②若NaOH和H2S反应产物为NaHS和Na2S的混合物,则根据极值法进行判断,
若产物只有NaHS,设8克NaOH反应可生成硫氢化钠的质量为x,
NaOH+H2S=NaHS+H2O
40 56
8g x
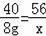

x=11.2g
若产物只有Na2S,设8克NaOH反应可生成硫化钠的质量为y,
2NaOH+H2S=Na2S+2H2O
80 78
8g y
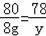

y=7.8g
而实际称得无水固体7.9g,7.8g<7.9g<11.2g,因此生成物可能是NaHS和Na2S的混合物.
③若NaOH过量,则产物为NaOH和Na2S的混合物,则生成固体质量应该介于7.8g和8.0g之间,而实际称得无水固体7.9g,因此固体混合物也可能是NaOH和Na2S的混合物.
综上所得,固体中一定含有的物质是Na2S.
故选A.
【点评】利用假设法或极限法,便于学生理解和掌握,考查了学生利用化学反应方程式进行计算的能力,提高了学生分析问题的能力.
网址:含8克NaOH的溶液中通入一定量的H2S气体后.可发生以下反应:NaOH+H2S=NaHS+H2O.2NaOH+H2S=Na2S+2H2O.将得到的溶液小心蒸干.称得无水固体7.9g.则该固体中一定含有的物质是( ) A.Na2S B.NaHS C.Na2S和NaHS D.Na2S和NaOH 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/1073695
相关内容
17.氢气(H2)一氧化碳(CO).辛烷(C8H15).甲烷(CH4)的热化学方程式分别为: H2(g)+O2(g)====H2O(1); △H=.(2)氧化剂与还原剂的物质的量之比是 .(3)若产生标况下22.4 L Cl2.则转 题目和参考答案——青夏教育精英家教网——
科学家设想利用NaOH溶液“捕捉CO2 .“释放CO2 .实现碳循环.工业生产中产生的CO2分离出来进行储存和利用.过程如下面流程图.(1)在捕捉室里发生的化学方程式为CO2+2NaOH=Na2CO3+H2O.(2)整个过程循环使用除了NaOH溶液.还有循环的物质的名称:氧化钙.在该过程中生成的CaCO3沉淀和NaOH溶液.通� 题目和参考答案——青夏教育精英家教网——
水溶液中H2S气体达到饱和([H2S] = 0.1 mol/L)时,溶液中[S2
如图所示是甲.乙.丙三种固体物质的溶解度曲线.(1)t2℃时.甲.乙.丙三种物质的溶解度大小关系是甲=乙>丙,(2)t1℃时.50g水中加入30g的甲物质充分溶解后.可得到60g溶液,(3)下列说法正确的是②④.①t1℃时.甲.丙两溶液的溶质质量分数一定相等②t3℃时.向100g20%甲的溶液中加100g水.充分搅拌.溶液的溶质质量分数为10%③t2℃时.升高丙 题目和参考答案——青夏教育精英家教网——
已知:在氢氧化钠浓溶液中加入氧化钙.加热.制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.(1)第一小组设计方案的流程如下:①写出n (OH
氯水不稳定,因为氯水中存在如下平衡:Cl2+H2O=HCl+HClO,为了提高氯水的稳定性,可以采取的办法是()?A.通入少量H2S气体B.通入少量NaOHC.通入少量HCl气体D.增大氯水浓度(答案为B,为什么?)请
工业烟气脱硫就是除去烟气中的二氧化硫.一种采用“双碱法 脱硫的工业流程示意图如下:(1)吸收塔中用 NaOH 溶液吸收 SO2.发生反应的化学方程式是2NaOH+SO2=Na2SO3+H2O.NaOH 溶液喷成雾状能充分吸收 SO2 的原因是增大反应物之间的接触面积.使反应更快更充分.(2)完成沉淀室中反应的化学方程式:Na2SO3+Ca(OH)2=Ca 题目和参考答案——青夏教育精英家教网——
已知醋酸和盐酸是日常生活中极为常见的酸.(1)常温常压.在 pH=5的稀醋酸溶液中.c= ,下列方法中.可以使0.10 mol/LCH3COOH的电离程度增大的是 .a.加入少量0.10 mol/L的稀盐酸b.加热CH3COOH溶液c.加入少量冰醋酸d.加水稀释至0.010 mol/Le.加入少量氯化钠固体f.加入少量0.10 mol/L的NaOH溶液 题目和参考答案——青夏教育精英家教网——
含氯消毒剂在生产、生活中有着广泛的用途。(1)工业上将Cl2溶于一定浓度的NaOH溶液,可制得“84”消毒液,反应的离子方程式为

