Application of microalgae in wastewater treatment and biomass recycling
'Making a business presentation in front of an audience',要有自信 #生活技巧# #职场沟通技巧# #商务英语#
摘要:随着经济的发展和人口的增加,环境污染和水资源短缺已经成为不可避免的全球性问题。基于微藻的废水处理技术不仅可以净化废水、解决环境污染问题,还可以利用废水中的营养元素合成生物质,现如今这种技术已经受到越来越多的关注。为了进一步提高废水处理效果、降低废水处理成本,有必要了解微藻去除废水中营养物质和污染物的机理,开发下游低成本收获技术,提升微藻高价值副产物的生产。本文综述了微藻去除碳、氮、磷、重金属、抗生素和有机物的机理和影响因素,总结了微藻的不同收获方式和微藻生物质在各个领域的应用。最后,分析了不同微藻共培养体系和微藻固定化技术的优缺点,并展望了微藻废水处理技术未来的发展方向。
Abstract: Amid economic and population growth, environmental pollution and water shortage have become problems faced around the world. Microalgae-based wastewater treatment can purify wastewater to tackle environmental pollution. In addition, the microalgae also use nutrients in wastewater to synthesize biomass. Thus, the technique has been popular. For the sake of high efficiency and low cost in wastewater treatment, it is necessary to clarify the mechanism by which microalgae remove nutrients and pollutants in wastewater, to develop low-cost downstream harvesting technology, and to improve the production of high-value by-products of microalgae. In this paper, the mechanism by which microalgae remove carbon, nitrogen, phosphorus, heavy metals, antibiotics, and organic matter and the influencing factors were reviewed, and the different harvesting methods of microalgae and the current applications of biomass in various fields were summarized. Finally, the advantages and disadvantages of different microalgal co-culture systems and microalgal immobilization techniques were analyzed, and the development of microalgae-based wastewater technology was predicted.
21世纪的主要挑战之一是克服世界水资源短缺的问题。造成这种水资源短缺的原因包括对水需求的增加、水资源的污染以及缺乏回收利用水的技术[1]。废水处理工艺的主要目标是在不造成重大损害的情况下,将废水重新利用或排放回环境。然而,传统的污染物去除方法存在高耗能和排放温室气体的问题,难以满足严格的废水排放标准[2]。
微藻是一种生长周期短、光合效率高、环境适应性强的生物。研究表明,微藻能直接利用环境中的无机碳源和营养物质,具有高效的脱氮除磷能力,同时其能够依靠生物吸附、生物积累和生物转化等方式对重金属进行去除。除了以上生理特性,微藻在实现废水中污染物去除的同时,还可以合成微藻生物质,实现废水的资源化利用[3]。因此,基于微藻的废水处理技术是一种经济的和可持续的废水处理方法。
本文综述了微藻对废水污染物去除的机制及其影响因素、资源的回收利用以及高效微藻复合系统等方面的潜在应用,最后指出了其存在的瓶颈和发展前景,为后续研究者提供参考。
1 微藻在废水处理中的应用 1.1 微藻去除污染物的机理 1.1.1 营养物
基于微藻的废水处理的主要功能是从废水中去除营养物并将其转化为藻类生物质。这整个过程离不开微藻对废水中碳、氮、磷等营养物质的摄取和转化。在光自养模式下,二氧化碳通过卡尔文循环被微藻固定;在异养模式下,废水中的有机碳化合物可通过直接穿过质膜或吞噬作用进入微藻细胞[4]。据报道,微藻可以同化废水中多种无机氮(如NH4+、NO3−和NO2−)和有机氮(如氨基酸、尿素、嘌呤和核苷)[5]。本课题组研究发现单针藻(Monoraphidium sp.) HDMA-01不仅能在高NH4+-N条件下生长,而且在氨氮浓度为14 mmol/L时,微藻的生物量和产油量可以达到78.9 mg/(L·d)和13.8 mg/(L·d),与同属藻株相比表现出明显优势,说明其有潜力应用于高铵废水处理[6]。对于无机氮,微藻表现出明显的偏好。在微藻的氨基酸合成代谢中,需要以NH4+-N为主要形式的无机氮供体分子。NH4+依次由谷氨酰胺合成酶(GS)和谷氨酰胺2-氧戊二酸氨基转移酶(GOGAT)催化[7],转化生成2种谷氨酸化合物[8]。同化后的氮可以通过转氨反应进一步形成其他氨基酸[9](图 1)。废水中的无机磷以几种离子状态存在,如H2PO4−、HPO42−和HPO4−。微藻可以利用磷的形式主要是磷酸二氢盐(H2PO4−)和磷酸氢盐(HPO4−),通过磷酸化作用将H2PO4−和HPO4−转换为有机化合物,如ATP。Zhou等[11]利用两阶段培养法研究了原生小球藻(Auxenochlorella protothecoides) UMN280对城市污水的处理效果,在自养微藻或异养微藻分别处理废水的基础上,Zhou将2种方式结合在一起,先利用城市废水异养培养了UMN280,然后在补充CO2的情况下进行自养培养,两阶段培养结束时,UMN280对总氮、总磷、氨氮和化学需氧量(chemical oxygen demand,COD)的去除率分别为90.60%、98.48%、100.00%和79.10%,提高了废水的养分去除效率。
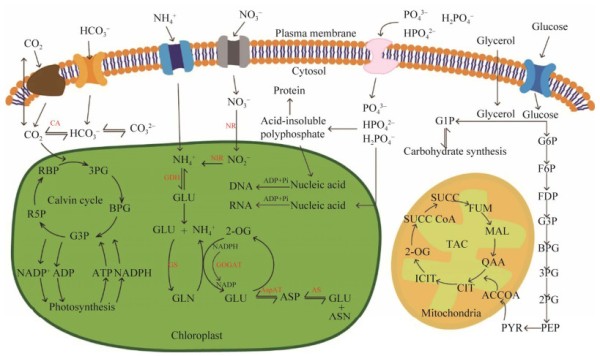 图 1 微藻吸收营养物转化途径示意图[10] Figure 1 Schematic illustration of nutriment absorption and transformation pathway by microalgae[10].
图 1 微藻吸收营养物转化途径示意图[10] Figure 1 Schematic illustration of nutriment absorption and transformation pathway by microalgae[10]. 1.1.2 重金属
目前废水中重金属的去除方法有化学沉淀法、膜分离法和吸附法等,但是这些方法都存在成本高的问题。微藻可以利用生物吸附、生物积累和生物转化等方式来去除水体中的重金属,以达到净水目的。微藻活细胞对重金属(HMs)的生物吸附是通过细胞壁上的官能团来实现的。微藻细胞壁中的大分子物质携带了多种带电基团,使得微藻细胞表面带有负电荷,能与重金属阳离子高度结合,形成配位配合物,此过程是可逆的[12]。而HMs的生物积累和生物转化是依靠细胞内发生的代谢过程,这通常是不可逆的。生物积累指的是HMs通过被动/主动运输途径由细胞膜进入细胞质,并在细胞内积累。事实上,HMs不能被降解,但它们可以从一种氧化态转化为另一种无机络合物,以减轻其毒性影响。进入细胞质内的重金属可以与蛋白质、脂类、碳水化合物、色素和其他抗氧化剂分子结合,这些分子可以将金属离子的电荷减少到零价态,或者被微藻中的氧化还原酶催化还原,从高毒性的化学形式转变为危害较小的形式[13]。Blanco-Vieites等[14]研究了几种微藻对钢铁工业废水的耐受性,发现极大节旋藻(Arthrospira maxima)对废水中总铁的去除率可以达到97.9%,这与Serrà等[15]得到的去除率相近。先前的研究表明,某些种类的微藻可以合成不同的分子作为螯合化合物,使金属离子更容易被微藻细胞吸收[16]。在此基础上,Blanco-Vieites等[14]的结果证明,在重金属修复过程中,A. maxima在重金属胁迫下会发生某些蛋白质表达来加强对金属离子吸附,但具体机制还需要进一步的研究,此试验是首次将工业规模微藻培养用于钢铁工业废水生物修复的研究,说明了A. maxima作为一种工业化废水重金属修复剂的潜力。
1.1.3 抗生素
城市废水中的抗生素一般来自医院、生活废水和制药厂废水[17]。微藻已被证明对大多数种类的抗生素都有去除作用,有望应用于废水中抗生素的处理过程[18]。微藻去除抗生素的机制包括生物吸附、生物积累、生物降解、光降解和水解。生物吸附是指抗生素被细胞壁上的结合位点吸附在细胞表面的过程。生物降解是指藻类在细胞内外分解抗生素,分解后的部分衍生物被藻类细胞进一步消耗的过程[19]。此外,由藻类代谢物引起的抗生素的水解也属于生物降解[20]。抗生素的光降解即藻类在光作用下产生的活性成分诱导抗生素发生分解[21]。Xiao等[22]的研究发现,经蛋白核小球藻(C. pyrenoidosa)处理头孢拉定溶液24 h后,头孢拉定的去除率达到41.47%。将蛋白核小球藻与铜绿假单胞菌及其过滤液分别共培养,去除效率进一步提高。此外,试验还发现蛋白核小球藻与活性污泥共培养,可以有效去除难治理性抗生素诺氟沙星,说明微藻共培养技术具有提升抗生素去除的潜能。
1.1.4 持久性有机污染物和新兴有机污染物
持久性有机污染物和新兴有机污染物包含各种化学类别的广泛化合物,例如个人护理产品、药品、阻燃剂和某些农药等[23]。目前常用的处理废水有机物的方法如吸附法、膜分离、化学絮凝、化学氧化法等处理效率低。近几年利用纳米材料和微塑料处理废水有机物的方法因效率较高受到广泛关注,但二者易被生物体摄取,可通过捕食进入食物链威胁人类健康[24]。相比而言,微藻在经济和安全方面具有巨大优势。以藻类为基础的废水处理技术,例如高通量微藻池(high-rate algal ponds,HRAPs),可以通过生物吸附、生物降解、生物积累等过程消除污染物[25],随后回收生物质资源来生产肥料和生物燃料等。使用HRAPs可以消除城市废水中多达99%的新兴有机污染物。在之前文献报道的大多数异养培养中,葡萄糖都被作为有机碳的来源被添加[26],近年发现未经处理的有机废水可以替代葡萄糖作为碳源。San Agustin等[27]利用城市养猪废水培养栅藻(Scenedesmus sp.),总有机碳(total organic carbon,TOC)、COD和生化需氧量(biochemical oxygen demand,BOD)均达到理想去除率。
1.2 影响微藻去除污染物效率的因素 1.2.1 光照
废水中的本地微生物群落可能会与添加到废水中的外源微藻共同竞争营养资源[28]。因此,必须建立一个环境,使得微藻的生长速率高于细菌和真菌。光照是微藻发挥生长代谢功能的基础,同时也是影响微藻生长速率的显著因素之一。Iasimone等[29]研究了不同光照强度[20–100 μmol /(s·m2)]对于城市废水中蓝藻、小球藻和栅藻混合物生长的影响。随着光照强度的增加,微藻总生物量和N-NH4+去除率都有明显增长。当光照强度为100 μmol /(s·m2),生物量达到243 mg/L,N-NH4+去除率与光照20 μmol /(s·m2)时相比增加了40.48%。微藻从光中捕获的能量为CO2固定所必需,在光饱和点以下,光合作用的速率与辐照强度成正比,高于光饱和点会导致受体系统受损,从而产生光抑制[30]。为了保证微藻的正常生长,试验中将微藻的光照强度保持在饱和点或低于饱和点即可。
1.2.2 温度
环境温度对微藻生物量和废水处理效率也有显著影响。例如光合作用中碳同化(即卡尔文循环)是由酶介导的,所以反应速率易受温度影响[11]。Ruiz-Martínez等[31]评估了栅藻(Scenedesmus sp.)在不同温度下对废水中NH4+-N的去除率,在温度为15、18、26、34 ℃时,NH4+-N去除率分别为4.3、6.7、15.7、17.0 mg/(NL·d)。然而,最佳温度已被证明取决于微藻的种类和它们对特定环境的适应[31]。一般来说,大多数微藻能够在10–30 ℃的温度下生存,而最佳温度范围更窄,通常为15–25 ℃[30]。在微藻处理废水过程中,通过反应器加热来保持最佳温度是不可行的,因为反应设备体积过大,需要消耗巨大的能量。因此,处理废水的藻种应根据废水处理厂的环境条件来选择。
1.2.3 营养物浓度
不同类型废水的理化特性如碳氮比(C/N)、氮磷比(N/P)和营养物的不同,对营养物去除率和微藻生长有很大影响[32]。Omar Faruque等[33]采用不同氮磷比(1:1–8:1)的人工合成三级城市污水进行了批量试验,栅藻(Scenedesmus dimorphus) UTEX B 746在N/P为2:1时,最高生物量为733 mg/L。当N/P从1:1增加到8:1时,脂肪积累量均呈下降趋势。值得注意的是,在N/P为1:1时脂肪积累量最高为28.6%,这些结果总体上支持了较低的N/P有利于较高的脂肪细胞含量的积累。废水中的营养物质很少,难以满足藻株生长的营养条件。通常采用以下2种方法来解决这一问题:一种是筛选或驯化微藻以适应废水,另一种是对废水进行预处理以满足微藻生长条件[34]。与微藻生长所需的条件相比,废水中不平衡的N/P和C/N比值往往影响微藻的生物量和营养物的去除率。有研究表明,针对营养物质不平衡的问题可以通过混合其他类型的废水来解决。
1.2.4 pH
据报道,绝大多数的淡水微藻生长所需的最佳pH一般在7–9[35]。废水的成分比较复杂,存在大量的好氧菌和兼性菌。这些微生物的代谢产物在一定程度会影响废水的pH,进而影响废水的处理效率。例如,微藻对无机碳的同化过程,会使废水pH值上升,导致碱性环境(pH > 9)。在这种环境下这些细菌的生长和功能会受损,使其在废水处理过程中没法发挥有益作用,甚至会对微藻的生长产生影响[36]。现有对微藻的研究主要集中在对废水中无机营养物质(即氮、磷)的去除上,而对作为主要污染物之一的油类的去除研究较少。2020年,Choong等[37]研究了pH值对农业废水中小球藻(Chlorella vulgaris)除油率和产油率的影响。结果发现在培养pH值为5时小球藻生长速度最高,其次是pH 7、9和11,培养pH值为3–5的条件下,微藻的脱油率最高,为41.56%,产油率为41.50%,脂肪含量为41.50%,根据结果可以看出该实验所用小球藻的最佳pH值要比大多数淡水微藻低很多。另外,有研究显示,pH值会影响微藻絮凝的效率[38],由于不同藻种对pH的敏感性不同,当选择微藻生长的最佳pH时,要考虑到实际应用的具体情况。因为在整个废水处理过程中,pH值是有一定波动的,所以最好选择能适应较大pH范围的微藻种类。
1.2.5 CO2浓度
此前有研究报道,废水中的碳源含量是限制微藻生长速率的主要原因之一[39]。碳源特别是无机碳的低可用性限制了微藻的生长,直接影响了微藻吸收氮、磷的量。为了提高废水介质中碳的可用性,通常采用CO2或碳酸氢盐形式的外源供应[40]。有研究报道,CO2的供应范围为1%–6%,被认为是促进微藻生长和营养物去除的最佳条件[41]。Omar Faruque等[33]根据三级城市污水成分合成废水基质作为培养基质,考察了不同CO2浓度下栅藻(Scenedesmus dimorphus) UTEX B 746的生长和产脂情况。研究发现,当未额外供应CO2时,生物质产量大约为466 mg/L。这一生物量产量明显低于当培养物中添加2%、4%和6%二氧化碳时的产量。在添加CO2浓度为2%时,生物量最高达到653 mg/L。添加6% CO2培养的微藻所形成的脂肪含量最高为31.6%。产脂率最高为6.6 mg/(L·d),此试验结果也证明了6%以下的CO2供应,确实可以增强微藻在废水中的生长。虽然CO2注入策略是增加微藻利用废水中碳的一个可行选择,但供应纯净二氧化碳价格昂贵。此外,CO2的供应可能会降低微藻的利用潜力,从而减少利用废水中的碳源物质。Hu等[42]报道了这种效应的发生,COD的减少率与所供应的CO2浓度成反比。间歇性地向微藻提供二氧化碳是一种可能缓解这一问题的潜在策略。这种方法可以促进微藻自养生长,然后异养消耗碳源物质。
2 微藻内生物质的回收再利用 2.1 微藻收获方法
将微藻从水中分离出来仍然是工业规模化应用的一个主要障碍。由于微藻的密度、颗粒形状和颗粒大小等基本属性[43],使得目前还不存在一种通用的收获方法。
2.1.1 物理方法
物理收获技术主要包括重力沉降、浮选、离心和过滤等。微藻细胞在培养基重力作用下沉降。沉降速率取决于细胞大小、细胞密度、营养物质浓度和光照利用率等。浮选法则是因为空气/气泡附着藻类颗粒的介质中,造成它们上升、漂浮和浓缩。离心方法是利用离心力从生长介质中分离微藻,只适用于小型和实验室规模的收获。膜生物反应器广泛应用于城市和工业废水处理。使用膜最大限度地从废水中回收营养物质是比较常见的[44]。膜技术的主要限制是微藻类会导致膜污染、堵塞和通量减少,从而增加运营成本[45]。
2.1.2 化学方法
化学方法常需要物理方法的辅助。微藻收获包括浓缩和脱水2个步骤,化学方法常被用在第一步中。首先加入混凝剂中和微藻的电荷,形成悬浮固体,微藻胶体悬浮液经混凝后加入絮凝剂。大絮凝体由此形成,然后在沉降机制下沉降。而离心或过滤则是将微藻细胞浓缩成糊状的主要脱水方法[46]。
2.1.3 生物方法
生物絮凝是一种成本低廉的微藻收获技术[47]。细菌和微藻的聚集产生了大型絮凝体,无需添加化学助剂或修改培养液的pH值就能在重力作用下沉降下来。例如,地衣芽孢杆菌(Bacillus licheniformis) CGMCC 2876产生的生物絮凝剂聚γ-谷氨酸被有效地用于浓缩栅藻(Desmodesmus sp.) F51,絮凝效率高达99%,收获效率为95%[48]。由于微藻-细菌絮凝体倾向于吸附悬浮化合物,因此该策略也可以作为一种提高废水中氮和磷去除效果的方法[49]。
2.2 微藻生物质的应用潜能
微藻可以根据物种和环境生长条件产生不同的大分子。在实际应用中,如果可以利用生物质中的这些组分生产高价值的生物产品(图 2),将大大提高微藻的经济效益。因此,高价值生物质的下游利用对微藻的工业化应用具有重要意义。
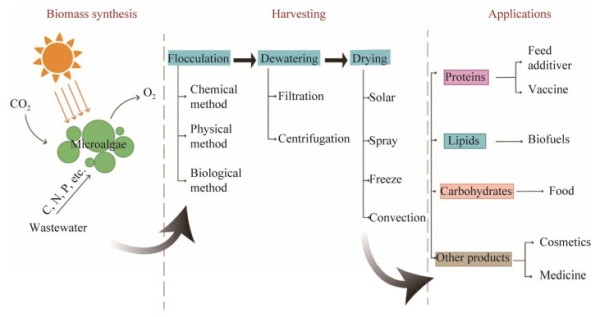 图 2 微藻生物质的合成、微藻的收获和生物质应用[50] Figure 2 Synthesis, harvesting and application of microalgae biomass[50].
图 2 微藻生物质的合成、微藻的收获和生物质应用[50] Figure 2 Synthesis, harvesting and application of microalgae biomass[50]. 2.2.1 类胡萝卜素
类胡萝卜素作为食品添加剂被广泛使用,需求量大。蔬菜和水果是类胡萝卜素的天然来源,但是种植作物受季节影响大,并且需要大面积耕地,微藻则恰好弥补了这些缺点。Cardoso等[51]利用养殖废水在室外中试规模培养螺旋藻(Spirulina sp.),产生的类胡萝卜素含量为9.68 μg/mL,废水中磷酸盐的去除率为99.97%,硝酸盐的去除率为81.10%,在生产类胡萝卜素的同时能够高效去除废水中的氮和磷。
2.2.2 碳水化合物
碳水化合物负责细胞结构、功能、能量来源和有机体的防御。Song等[52]的研究发现栅藻(Scenedesmus sp.) 336可以在啤酒废水处理过程中积累63.61 mg/L的碳水化合物。另外,在养猪场废水中培养栅藻属微藻,在其生物质中可提取81%的单糖(葡萄糖和木糖)[53]。这些碳水化合物可用于食品、饲料、制药、增稠剂、保健品、治疗剂和化妆品的生产[54]。
2.2.3 蛋白质
传统粮食作物提取蛋白质的方法存在环境污染问题,且提取的蛋白质含量低,微藻蛋白则是一种可行的选择。研究表明,利用混养微藻处理乳品废水后,在收获的微藻生物质中,可以获得高达38.9%的碳水化合物和15.6%的蛋白质[55]。微藻中蛋白质含量甚至可以到达细胞干重的50%–70%,有望成为一种新型的低成本蛋白质供应源[56]。
2.2.4 生物燃料生产
可以从微藻中获得的生物燃料包括生物柴油、生物氢、生物甲烷和生物乙醇。作者所在实验室研究证明,单针藻(Monoraphidium sp.) HDMA-11和HDMA-20能产生大量的脂肪酸,特别是亚麻酸,使其适合作为人类健康的营养补充来源。另外,HDMA-11还具有较高的脂肪含量(占干重的28.5%)和良好的脂肪酸组成,可用于生产生物柴油[57–58]。此外,微藻还能够吸收化石燃料燃烧过程中排放的CO2,用于生产生物燃料,具有环境效益[59]。以乳业废水作为培养基培养衣藻时发现,油脂产量为(87.5±2.3) mg/(L·d),且脂肪酸链组成适用于生物燃料生产[60]。
2.2.5 沼气生产
微藻生物质是潜在的沼气来源,可进一步用于电力、燃料电池和液体燃料的生产。藻类生物量中木质素和纤维素含量较低,易通过消化转化为沼气[61]。在生产沼气方面,Solé-Bundó等[62]采用连续反应器系统共消化藻类和污泥,与微藻单消化系统进行了20 d的效率比较。结果表明共消化对生物质的厌氧消化有很大的促进作用,高效地将甲烷产量提高到65%。
3 提高微藻处理废水效率和生物质合成的措施 3.1 微藻共培养系统 3.1.1 微藻-微藻共培养
共培养是一种环保、高效的生物技术,2种藻株共培养对生物量和油脂的产量都有积极的影响[63]。并且,微藻之间的相互作用导致胞外多聚物(extracellular polymeric substance,EPS)产量上升,此过程作为一种适应不利条件的代谢策略,实现了微藻高密度培养并产生相对较高的生长速度[64]。在进行共培养试验时,也有一些需要注意的问题。如过多的EPS积累可能会抑制传质过程,阻碍养分的吸收,并使微藻无法吸收溶解的CO2[65]。因此,在微藻-微藻共培养中,选择合适的藻种是十分重要的。微藻-微藻共培养的方法除了能提高微藻生物量、油脂的产量,还有助于不同废水的生物修复,并促进生物絮凝,从而有效地收获生物质[63]。
3.1.2 微藻-细菌共培养
与单独培养微藻或细菌相比,微藻与特定细菌共培养可以提高废水处理的效率。Sharma等[53]的试验表明,巨型芽孢杆菌(Bacillus megaterium)可以去除废水中的化学需氧量(COD)和总磷(TP),但当其与微藻共培养时,COD和TP的去除率分别提高了175.63%和133.38%。这说明微藻与细菌在处理废水上存在着协同优势。在共培养体系中,微藻和细菌之间不断进行着有机物和无机物的交换,微藻通过光合作用消耗CO2为细菌提供了O2和有机物,而细菌代谢产生的CO2则能再次被微藻利用[66],同时细菌呼吸产生的磷酸盐也是微藻生长中的必需物质[67]。两者之间的物质交换不仅能促进彼此的生长,还能增强微藻的絮凝性,有利于后期微藻的回收。这种相互作用是微藻和细菌能够共培养的基础。
3.1.3 微藻-真菌共培养
因为真菌本身具有大量的降解酶和特殊的表面特性,所以在废水处理方面已经有了广泛的应用,例如对重金属的吸附[68]、对药物和有机物的生物降解[69]和对染料的脱色[70]等。有研究发现,在适宜的培养条件下,真菌可以通过表面的静电中和、蛋白相互作用或者胞外多糖的粘附性等方法来结合微藻,形成真菌-微藻颗粒体,经过简单的物理处理就可以从废水中分离出来,降低回收成本。同时,真菌-微藻颗粒的特殊结构对于废水中悬浮固体的去除也大有帮助。Yang等[71]将丝状真菌加入到微藻处理系统,结果发现,废水中NH4+-N的去除率从19%大幅增长到94.72%,预示着微藻与真菌共培养在废水处理方面的潜能。
3.1.4 微藻-活性污泥共培养
自1923年上海建立了第一座采用活性污泥法(activated sludge methods,ASPs)的废水处理厂开始,活性污泥法一直是应用最广的废水处理工艺。ASPs中细菌的呼吸作用和营养物质的代谢需要大量的氧气,为满足这种必需的要求则会产生高能量消耗。据了解曝气过程的能源要占总使用能源的60%–80%[70]。而微藻的光合作用可以产生氧气,这使得微藻有可能成为一种天然的曝气装置,来代替传统的机械曝气装置,节省ASPs的曝气能源成本[72]。另外活性污泥具有更好的沉降能力,能够弥补微藻在絮凝和回收方面的不足。微藻主要在废水中营养物的去除方面发挥作用,而活性污泥则主要负责COD的去除[73]。所以基于微藻和活性污泥共生关系的共培养系统是废水处理中一种可持续并具有成本效益的选择[74]。
3.1.5 微藻-纳米颗粒
纳米颗粒具有较高的比表面积和快速的吸附性能,在废水处理中具有巨大的潜力。众所周知,许多纳米材料可以修复污染物,包括碳纳米管、锰氧化物、二氧化钛和氧化锌。纳米颗粒对特定废水的适应性取决于其大小、浓度、细胞毒性试验和比表面积[75]。ZnO-微藻能提升废水中COD、TN和TP的去除率[76]。Fe2O3-微藻复合物能有效去除废水中的重金属[77]。最近的一项研究发现[52],ZnO-片球藻(Chlorosarcinopsis sp.) AS04复合体可以从一、二次处理的废水中分别去除97.50%、87.20%、82.21%和95.30%、85.20%、81.50%的总有机碳(TOC)、TN和TP,处理废水效果明显高于微藻单处理系统。
3.2 微藻固定化体系
微藻固定化是将微生物固定在基质中的一种技术,自40多年前开始,微藻固定化已被广泛用于各种生物技术。固定化微藻用于废水处理的原理是使活细胞在凝胶基质中尽可能长时间保持代谢活性,虽然在此期间它们的流动性非常有限,但是这同时也避免微藻被浮游动物捕食,减少微藻与其他微生物物种对营养物质的竞争。在污染物被微藻吸收后,较干净的水从聚合物中扩散出来,并被收集和再利用,这个过程重复几个循环,最后得到的水即可直接使用。固定化方法还可以提高微藻对废水中有毒化合物的抗性,并且不同的微藻固定化系统可以在一个生物反应器中混合,利用不同的微生物同时处理废水中的几种污染物,提高处理效率,特别是针对需要专门的微藻来降解的顽固性化合物[78]。
4 总结与展望
基于微藻的废水处理技术和微藻生物质及附加产品的生产具有很大的应用前景。综述详细介绍了微藻去除营养物质和污染物的机理和影响因素,讨论了提升微藻处理废水及生物量回收效率的最新方法,并对生物质的进一步利用做了详细阐述。总体而言,目前大多数基于微藻的废水处理和生物质生产技术仍停留在实验室规模,需要后续试验评估pH、CO2浓度和温度等参数对废水处理效率和生物质生产率的影响,以获得工业规模培养的最佳条件。从废水中回收微藻是一个重要且最耗能的步骤,本文总结的微藻回收方法依赖于微藻的性质,因此存在不足之处,如很难去除非常小尺寸的微藻、设备维护成本高、絮凝剂容易造成水体二次污染和过滤器堵塞或结垢。因此未来应探索新型自絮凝和本地适应良好的微藻藻株,来达到简化收获过程和降低收获成本的目的。另外,现在对于微藻处理废水和合成生物质的研究还不够深入,接下来应该依靠转录组和代谢组等技术来加强对微藻细胞代谢通路的了解并获得相关靶基因信息,利用基因工程技术对靶基因进行改造,以提高微藻对复杂环境的耐受性和生物量的生产效率。总的来说,微藻生物技术用于处理废水和生产高价值副产物不仅对环境友好,还可以对人类健康、食品安全以及气候变化产生有利影响。
References
[1] Hussain F, Shah SZ, Ahmad H, Abubshait SA, Abubshait HA, Laref A, Manikandan A, Kusuma HS, Iqbal M. Microalgae an ecofriendly and sustainable wastewater treatment option: biomass application in biofuel and bio-fertilizer production. A review. Renewable and Sustainable Energy Reviews, 2021, 137: 110603. DOI:10.1016/j.rser.2020.110603 [2] Liu XY, Hong Y. Microalgae-based wastewater treatment and recovery with biomass and value-added products: a brief review. Current Pollution Reports, 2021, 7(2): 227-245. DOI:10.1007/s40726-021-00184-6 [3] Ahmad A, Banat F, Alsafar H, Hasan SW. Algae biotechnology for industrial wastewater treatment, bioenergy production, and high-value bioproducts. The Science of the Total Environment, 2022, 806(pt 2): 150585. [4] Tanner W. The Chlorella hexose/H(+)-symporters. International Review of Cytology, 2000, 200: 101-141. [5] Ross ME, Davis K, McColl R, Stanley MS, Day JG, Semião AJC. Nitrogen uptake by the macro-algae Cladophora coelothrix and Cladophora parriaudii: influence on growth, nitrogen preference and biochemical composition. Algal Research, 2018, 30: 1-10. DOI:10.1016/j.algal.2017.12.005 [6] Lin YM, Song G, Ling HZ, Ge JP, Ping WX. Isolation of a high-ammonium-tolerant Monoraphidium sp. and evaluation of its potential for biodiesel production. Process Biochemistry, 2021, 111: 297-304. DOI:10.1016/j.procbio.2021.11.010 [7] Lu B, Yuan Y, Zhang C, Ou J, Zhou WLQ. Modulation of key enzymes involved in ammonium assimilation and carbon metabolism by low temperature in rice (Oryza sativa L.) roots. Plant Science, 2005, 169(2): 295-302. DOI:10.1016/j.plantsci.2004.09.031 [8] Inokuchi R, Kuma KI, Miyata T, Okada M. Nitrogen-assimilating enzymes in land plants and algae: phylogenic and physiological perspectives. Physiologia Plantarum, 2002, 116(1): 1-11. DOI:10.1034/j.1399-3054.2002.1160101.x [9] Miflin BJ, Habash DZ. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops. Journal of Experimental Botany, 2002, 53(370): 979-987. DOI:10.1093/jexbot/53.370.979 [10] Mohsenpour SF, Hennige S, Willoughby N, Adeloye A, Gutierrez T. Integrating micro-algae into wastewater treatment: a review. The Science of the Total Environment, 2021, 752: 142168. DOI:10.1016/j.scitotenv.2020.142168 [11] Zhou WG, Min M, Li YC, Hu B, Ma XC, Cheng YL, Liu YH, Chen PRR. A hetero-photoautotrophic two-stage cultivation process to improve wastewater nutrient removal and enhance algal lipid accumulation. Bioresource Technology, 2012, 110: 448-455. DOI:10.1016/j.biortech.2012.01.063 [12] Danouche M, El Ghachtouli N, El Arroussi H. Phycoremediation mechanisms of heavy metals using living green microalgae: physicochemical and molecular approaches for enhancing selectivity and removal capacity. Heliyon, 2021, 7(7): e07609. DOI:10.1016/j.heliyon.2021.e07609 [13] Leong YK, Chang JS. Bioremediation of heavy metals using microalgae: recent advances and mechanisms. Bioresource Technology, 2020, 303: 122886. DOI:10.1016/j.biortech.2020.122886 [14] Blanco-Vieites M, Suárez-Montes D, Delgado F, Álvarez-Gil M, Hernández Battezb A, Rodríguezb E. Removal of heavy metals and hydrocarbons by microalgae from wastewater in the steel industry. Algal Research, 2022, 64: 102700. DOI:10.1016/j.algal.2022.102700 [15] Serrà A, Artal R, Garcia-Amoros J, Gómez E, Philippe L. Circular zero-residue process using microalgae for efficient water decontamination, biofuel production, and carbon dioxide fixation. Chemical Engineering Journal, 2020, 388: 124278. DOI:10.1016/j.cej.2020.124278 [16] Khatiwada B, Hasan MT, Sun A, Kamath KS, Mirzaei M, Sunna A, Nevalainen H. Proteomic response of Euglena gracilis to heavy metal exposure-identification of key proteins involved in heavy metal tolerance and accumulation. Algal Research, 2020, 45: 101764. DOI:10.1016/j.algal.2019.101764 [17] Szekeres E, Baricz A, Chiriac CM, Farkas A, Opris O, Soran ML, Andrei AS, Rudi K, Balcázar JL, Dragos N, Coman C. Abundance of antibiotics, antibiotic resistance genes and bacterial community composition in wastewater effluents from different Romanian hospitals. Environmental Pollution, 2017, 225: 304-315. DOI:10.1016/j.envpol.2017.01.054 [18] Angulo E, Bula L, Mercado I, Montaño A, Cubillán N. Bioremediation of cephalexin with non-living Chlorella sp., biomass after lipid extraction. Bioresource Technology, 2018, 257: 17-22. DOI:10.1016/j.biortech.2018.02.079 [19] Gao J, Chi J. Biodegradation of phthalate acid esters by different marine microalgal species. Marine Pollution Bulletin, 2015, 99(1/2): 70-75. [20] Leng L, Wei L, Xiong Q, Xu S, Li W, Lv S, Lu Q, Wan L, Wen Z, Zhou W. Use of microalgae based technology for the removal of antibiotics from wastewater: a review. Chemosphere, 2020, 238: 124680. DOI:10.1016/j.chemosphere.2019.124680 [21] Chen J, Xie S. Overview of sulfonamide biodegradation and the relevant pathways and microorganisms. The Science of the Total Environment, 2018, 640/641: 1465-1477. DOI:10.1016/j.scitotenv.2018.06.016 [22] Xiao G, Chen J, Show PL, Yang Q, Ke J, Zhao Q, Guo R, Liu Y. Evaluating the application of antibiotic treatment using algae-algae/activated sludge system. Chemosphere, 2021, 282: 130966. DOI:10.1016/j.chemosphere.2021.130966 [23] Kurade MB, Kim JR, Govindwar SP, Jeon BH. Insights into microalgae mediated biodegradation of diazinon by Chlorella vulgaris: microalgal tolerance to xenobiotic pollutants and metabolism. Algal Research, 2016, 20: 126-134. DOI:10.1016/j.algal.2016.10.003 [24] Ge J, Yang Q, Fang Z, Liu S, Zhu Y, Yao J, Ma Z, Gonçalves RJ, Guan W. Microplastics impacts in seven flagellate microalgae: role of size and cell wall. Environmental Research, 2022, 206: 112598. DOI:10.1016/j.envres.2021.112598 [25] Salama ES, Kurade MB, Abou-Shanab RAI, El-Dalatony MM, Yang IS, Min BJ, Byong H. Recent progress in microalgal biomass production coupled with wastewater treatment for biofuel generation. Renewable and Sustainable Energy Reviews, 2017, 79: 1189-1211. DOI:10.1016/j.rser.2017.05.091 [26] Di Caprioa F, Altimaria P, Ianquaniellob G, Toro L, Pagnanelli F. T. obliquus cultivation under heterotrophic conditions: determination of growth parameters. Chemical Engineering, 2019, 74: 133-138. [27] San Agustin DM, Ledesma MTO, Ramírez IM, Noguez IY, Pabello VML, Velasquez-Orta SB. A non-sterile heterotrophic microalgal process for dual biomass production and carbon removal from swine wastewater. Renewable Energy, 2022, 181: 592-603. DOI:10.1016/j.renene.2021.09.028 [28] Lee J, Lee J, Lee TK, Woo SG, Baek GS, Park J. In-depth characterization of wastewater bacterial community in response to algal growth using pyrosequencing. Journal of Microbiology and Biotechnology, 2013, 23(10): 1472-1477. DOI:10.4014/jmb.1303.03022 [29] Iasimone F, Panico A, De Felice V, Fantasma F, Iorizzi M, Pirozzi F. Effect of light intensity and nutrients supply on microalgae cultivated in urban wastewater: biomass production, lipids accumulation and settleability characteristics. Journal of Environmental Management, 2018, 223: 1078-1085. DOI:10.1016/j.jenvman.2018.07.024 [30] Williams PJLB, Laurens LML. Microalgae as biodiesel and biomass feedstocks: review and analysis of the biochemistry, energetics and economics. Energy and Environmental Science, 2010, 3(5): 554-590. DOI:10.1039/b924978h [31] Ruiz-Martínez A, Serralta J, Seco A, Ferrer J. Effect of temperature on ammonium removal in Scenedesmus sp.. Bioresource Technology, 2015, 191: 346-349. DOI:10.1016/j.biortech.2015.05.070 [32] Cai T, Park SY, Li YB. Nutrient recovery from wastewater streams by microalgae: status and prospects. Renewable and Sustainable Energy Reviews, 2013, 19: 360-369. DOI:10.1016/j.rser.2012.11.030 [33] Omar Faruque M, Ilyas M, Mozahar Hossain M, Abdur Razzak S. Influence of nitrogen to phosphorus ratio and CO2 concentration on lipids accumulation of Scenedesmus dimorphus for bioenergy production and CO2 biofixation. Chemistry, an Asian Journal, 2020, 15(24): 4307-4320. DOI:10.1002/asia.202001063 [34] Li K, Liu Q, Fang F, Luo R, Lu Q, Zhou W, Huo S, Cheng P, Liu J, Addy M, Chen P, Chen D, Ruan R. Microalgae-based wastewater treatment for nutrients recovery: a review. Bioresource Technology, 2019, 291: 121934. DOI:10.1016/j.biortech.2019.121934 [35] Kumar A, Ergas S, Yuan X, Sahu A, Zhang Q, Dewulf J, Malcata FX, Van Langenhove H. Enhanced CO2 fixation and biofuel production via microalgae: recent developments and future directions. Trends in Biotechnology, 2010, 28(7): 371-380. DOI:10.1016/j.tibtech.2010.04.004 [36] Ansa EDO, Lubberding HJ, Ampofo JA, Gijzen HJ. The role of algae in the removal of Escherichia coli in a tropical eutrophic lake. Ecological Engineering, 2011, 37(2): 317-324. DOI:10.1016/j.ecoleng.2010.11.023 [37] Choong YJ, Yokoyama H, Matsumura Y, Lam MK, Uemura Y, Dasan YK, Kadir WNA, Lim JW. The potential of using microalgae for simultaneous oil removal in wastewater and lipid production. International Journal of Environmental Science and Technology, 2020, 17(5): 2755-2766. DOI:10.1007/s13762-020-02701-4 [38] Chen J, Leng L, Ye C, Lu Q, Addy M, Wang J, Liu J, Chen P, Ruan R, Zhou W. A comparative study between fungal pellet- and spore-assisted microalgae harvesting methods for algae bioflocculation. Bioresource Technology, 2018, 259: 181-190. DOI:10.1016/j.biortech.2018.03.040 [39] Arias DM, Uggetti E, García-Galán MJ, García J. Cultivation and selection of cyanobacteria in a closed photobioreactor used for secondary effluent and digestate treatment. The Science of the Total Environment, 2017, 587/588: 157-167. DOI:10.1016/j.scitotenv.2017.02.097 [40] Kesaano M, Gardner RD, Moll K, Lauchnor E, Gerlach R, Peyton BM, Sims RC. Dissolved inorganic carbon enhanced growth, nutrient uptake, and lipid accumulation in wastewater grown microalgal biofilms. Bioresource Technology, 2015, 180: 7-15. DOI:10.1016/j.biortech.2014.12.082 [41] Yao L, Shi J, Miao X. Mixed wastewater coupled with CO2 for microalgae culturing and nutrient removal. PLoS One, 2015, 10(9): e0139117. DOI:10.1371/journal.pone.0139117 [42] Hu B, Min M, Zhou WG, Li YC, Mohr M, Cheng YL, Lei HW, Liu YH, Lin XY, Chen P, Ruan R. Influence of exogenous CO2 on biomass and lipid accumulation of microalgae Auxenochlorella protothecoides cultivated in concentrated municipal wastewater. Applied Biochemistry and Biotechnology, 2012, 166(7): 1661-1673. DOI:10.1007/s12010-012-9566-2 [43] Kadir WNA, Lam MK, Uemura Y, Lim JW, Lee KT. Harvesting and pre-treatment of microalgae cultivated in wastewater for biodiesel production: a review. Energy Conversion and Management, 2018, 171: 1416-1429. DOI:10.1016/j.enconman.2018.06.074 [44] Morillas-España A, Sánchez-Zurano A, Lafarga T, Morales-Amaral M, Gómez-Serrano C, Acién-Fernández FG, González-López CV. Improvement of wastewater treatment capacity using the microalga Scenedesmus sp. and membrane bioreactors. Algal Research, 2021, 60: 102516. DOI:10.1016/j.algal.2021.102516 [45] Singh G, Patidar SK. Microalgae harvesting techniques: a review. Journal of Environmental Management, 2018, 217: 499-508. [46] Fasaei F, Bitter JH, Slegers PMV, Boxtel AJB. Techno-economic evaluation of microalgae harvesting and dewatering systems. Algal Research, 2018, 31: 347-362. DOI:10.1016/j.algal.2017.11.038 [47] Nazari MT, Freitag JF, Cavanhi VAF, Colla LM. Microalgae harvesting by fungal-assisted bioflocculation. Reviews in Environmental Science and Bio/Technology, 2020, 19(2): 369-388. DOI:10.1007/s11157-020-09528-y [48] Ndikubwimana T, Zeng X, Liu Y, Chang JS, Lu Y. Harvesting of microalgae Desmodesmus sp. F51 by bioflocculation with bacterial bioflocculant. Algal Research, 2014, 6: 186-193. DOI:10.1016/j.algal.2014.09.004 [49] Ummalyma SB, Gnansounou E, Sukumaran RK, Sindhu R, Pandey A, Sahoo D. Bioflocculation: an alternative strategy for harvesting of microalgae - an overview. Bioresource Technology, 2017, 242: 227-235. DOI:10.1016/j.biortech.2017.02.097 [50] Pang N, Gu X, Chen S, Kirchhoff H, Lei H, Roje S. Exploiting mixotrophy for improving productivities of biomass and co-products of microalgae. Renewable and Sustainable Energy Reviews, 2019, 112: 450-460. DOI:10.1016/j.rser.2019.06.001 [51] Cardoso LG, Duarte JH, Andrade BB, Lemos PVF, Costa JAV, Druzian JI, Chinalia FA. Spirulina sp. Leb 18 cultivation in outdoor pilot scale using aquaculture wastewater: high biomass, carotenoid, lipid and carbohydrate production. Aquaculture, 2020, 525: 735272. DOI:10.1016/j.aquaculture.2020.735272 [52] Song CF, Hu XF, Liu ZZ, Li SH, Kitamura Y. Combination of brewery wastewater purification and CO2 fixation with potential value-added ingredients production via different microalgae strains cultivation. Journal of Cleaner Production, 2020, 268: 122332. DOI:10.1016/j.jclepro.2020.122332 [53] Sharma R, Mishra A, Pant D, Malaviya P. Recent advances in microalgae-based remediation of industrial and non-industrial wastewaters with simultaneous recovery of value-added products. Bioresource Technology, 2022, 344(pt b): 126129. [54] Raposo MF, De Morais RM, Bernardo De Morais AM. Bioactivity and applications of sulphated polysaccharides from marine microalgae. Marine Drugs, 2013, 11(1): 233-252. DOI:10.3390/md11010233 [55] Hemalatha M, Sravan JS, Min B, Venkata Mohan S. Microalgae-biorefinery with cascading resource recovery design associated to dairy wastewater treatment. Bioresource Technology, 2019, 284: 424-429. DOI:10.1016/j.biortech.2019.03.106 [56] Hempel F, Maier UG. Microalgae as solar-powered protein factories. Advanced Technologies for Protein Complex Production and Characterization, 2016: 241-262. [57] Yu XY, Zhao P, He CA, Li JJ, Tang XH, Zhou JP, Huang ZX. Isolation of a novel strain of Monoraphidium sp. and characterization of its potential application as biodiesel feedstock. Bioresource Technology, 2012, 121: 256-262. DOI:10.1016/j.biortech.2012.07.002 [58] Lin YM, Ge JP, Zhang YY, Ling HZ, Yan XF, Ping WX. Monoraphidium sp. HDMA-20 is a new potential source of α-linolenic acid and eicosatetraenoic acid. Lipids in Health and Disease, 2019, 18(1): 56. DOI:10.1186/s12944-019-0996-5 [59] Coronado CR, De Carvalho JA, Silveira JL. Biodiesel CO2 emissions: a comparison with the main fuels in the brazilian market. Fuel Processing Technology, 2009, 90(2): 204-211. DOI:10.1016/j.fuproc.2008.09.006 [60] Arora N, Patel A, Sartaj K, Pruthi PA, Pruthi V. Bioremediation of domestic and industrial wastewaters integrated with enhanced biodiesel production using novel oleaginous microalgae. Environmental Science and Pollution Research, 2016, 23(20): 20997-21007. DOI:10.1007/s11356-016-7320-y [61] Harun R, Davidson M, Doyle M, Gopiraj R, Danquah M, Forde G. Technoeconomic analysis of an integrated microalgae photobioreactor, biodiesel and biogas production facility. Biomass and Bioenergy, 2011, 35(1): 741-747. DOI:10.1016/j.biombioe.2010.10.007 [62] Solé-Bundó M, Garfí M, Matamoros V, Ferrer I. Co-digestion of microalgae and primary sludge: effect on biogas production and microcontaminants removal. The Science of the Total Environment, 2019, 660: 974-981. DOI:10.1016/j.scitotenv.2019.01.011 [63] Ray A, Nayak M, Ghosh A. A review on co-culturing of microalgae: a greener strategy towards sustainable biofuels production. The Science of the Total Environment, 2022, 802: 149765. DOI:10.1016/j.scitotenv.2021.149765 [64] Ramanan R, Kim BH, Cho DH, Oh HM, Kim HS. Algae-bacteria interactions: evolution, ecology and emerging applications. Biotechnology Advances, 2016, 34(1): 14-29. DOI:10.1016/j.biotechadv.2015.12.003 [65] Ray A, Banerjee S, Das D. Microalgal bio-flocculation: present scenario and prospects for commercialization. Environmental Science and Pollution Research, 2021, 28(21): 26294-26312. DOI:10.1007/s11356-021-13437-0 [66] Kumar A, Singh JS. Cyanoremediation: a green-clean tool for decontamination of synthetic pesticides from agro- and aquatic ecosystems. Agro-Environmental Sustainability, 2017: 59-83. [67] Li D, Liu RQ, Cui XY, He ML, Zheng SY, Du WJ, Gao M, Wang CH. Co-culture of bacteria and microalgae for treatment of high concentration biogas slurry. Journal of Water Process Engineering, 2021, 41: 102041. DOI:10.1016/j.jwpe.2021.102041 [68] Dhankhar R, Hooda A. Fungal biosorption - an alternative to meet the challenges of heavy metal pollution in aqueous solutions. Environmental Technology, 2011, 32(5): 467-491. DOI:10.1080/09593330.2011.572922 [69] Mathimani T, Mallick N. A comprehensive review on harvesting of microalgae for biodiesel-key challenges and future directions. Renewable and Sustainable Energy Reviews, 2018, 91: 1103-1120. DOI:10.1016/j.rser.2018.04.083 [70] Kaushik P, Malik A. Fungal dye decolourization: recent advances and future potential. Environment International, 2009, 35(1): 127-141. DOI:10.1016/j.envint.2008.05.010 [71] Yang L, Li H, Wang Q. A novel one-step method for oil-rich biomass production and harvesting by co-cultivating microalgae with filamentous fungi in molasses wastewater. Bioresources Technology, 2019, 275: 35-43. DOI:10.1016/j.biortech.2018.12.036 [72] Nguyen TT, Nguyen TT, An Binh Q, Bui XT, Ngo HH, Vo HNP, Andrew Lin KY, Vo TD, Guo W, Lin C, Breider F. Co-culture of microalgae-activated sludge for wastewater treatment and biomass production: exploring their role under different inoculation ratios. Bioresources Technology, 2020, 314: 123754. DOI:10.1016/j.biortech.2020.123754 [73] Gutzeit G, Lorch D, Weber A, Engels M, Neis U. Bioflocculent algal-bacterial biomass improves low-cost wastewater treatment. Water Science and Technology, 2005, 52(12): 9-18. DOI:10.2166/wst.2005.0415 [74] Mujtaba G, Lee K. Treatment of real wastewater using co-culture of immobilized Chlorella vulgaris and suspended activated sludge. Water Research, 2017, 120: 174-184. DOI:10.1016/j.watres.2017.04.078 [75] Chen P, Powell BA, Mortimer M, Ke PC. Adaptive interactions between zinc oxide nanoparticles and Chlorella sp.. Environmental Science & Technology, 2012, 46(21): 12178-12185. [76] Nagabalaji V, Sivasankari G, Srinivasan SV, Suthanthararajan R, Ravindranath E. Nutrient removal from synthetic and secondary treated sewage and tannery wastewater through phycoremediation. Environmental Technology, 2019, 40(6): 784-792. DOI:10.1080/09593330.2017.1408689 [77] Shen L, Wang J, Li Z, Fan L, Chen R, Wu X, Li J, Zeng W. A high-efficiency Fe2O3@microalgae composite for heavy metal removal from aqueous solution. Journal of Water Process Engineering, 2020, 33: 101026. DOI:10.1016/j.jwpe.2019.101026 [78] De-Bashan LE, Bashan Y. Immobilized microalgae for removing pollutants: review of practical aspects. Bioresource Technology, 2010, 101(6): 1611-1627. DOI:10.1016/j.biortech.2009.09.043网址:Application of microalgae in wastewater treatment and biomass recycling https://www.yuejiaxmz.com/news/view/1312919
相关内容
Technical status and trends in animal wastewater treatmentReview on the control and mitigation strategies of lake cyanobacterial blooms
Recent progress and perspectives in biological treatment for gaseous pollutants
Progress of the Role of Probiotics in the Prevention and Treatment of Allergic Diseases
自然村生产生活废弃物循环利用模式及其评价研究
Application and research progress of Individual and Family Self
生物质资源能源化与高值利用研究现状及发展前景
Mechanisms and applications of bacterial
Overseas and domestic research progress in application and optimization of drinking water disinfection technology
The effect on patient life quality of prophylactic treatment to seasonal allergic rhinitis and related transcriptomics research

