实验室根据“侯氏制碱法”原理制备少量NaHCO3:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。其实验包括制取氨气→制取NaHCO3→分离NaH
《甜品实验室》探索甜点制作的科学原理 #生活乐趣# #美食烹饪乐趣# #美食纪录片#
题型:单选题 难度:0.65 引用次数:496 题号:7721716
实验室根据“侯氏制碱法”原理制备少量NaHCO3:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。其实验包括制取氨气→ 制取NaHCO3→分离NaHCO3→干燥NaHCO3四个步骤。下列实验必须选用的主要仪器正确的是: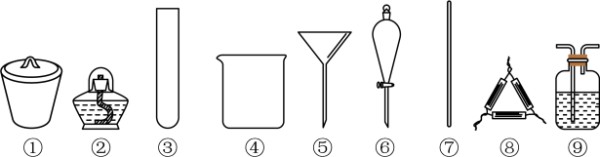
2019·湖北·一模 查看更多[5]
更新时间:2019/03/11 08:39:28 |
纠错 收藏
下载加入试卷
【知识点】 氨气的实验室制法解读 常见无机物的制备解读 物质制备的探究解读 纯碱的生产解读
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐氨气的实验室制法常见无机物的制备物质制备的探究纯碱的生产
单选题 | 适中 (0.65)
名校
解题方法
无机物制备类实验方案的设计与评价
【推荐1】现用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是
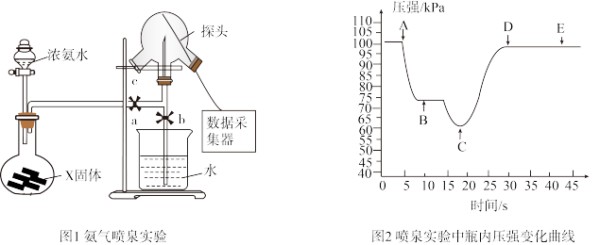
2023-03-25更新 | 717次组卷
纠错 收藏 详情 加入试卷
单选题 | 适中 (0.65)
名校
解题方法
化学用语
【推荐2】宏观辨识与微观探析是化学核心素养之一,下列有关方程式与所述事实相符合的是
A.电解熔融制取Mg:B.实验室制氨气: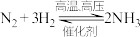 C.工业制漂白粉:D.过量的铁粉在中燃烧:
C.工业制漂白粉:D.过量的铁粉在中燃烧: 2024-03-10更新 | 198次组卷
纠错 收藏 详情 加入试卷
单选题 | 适中 (0.65)
名校
解题方法
无机物制备类实验方案的设计与评价
【推荐3】利用下列装置进行实验(夹持仪器已省略),能达到实验目的的是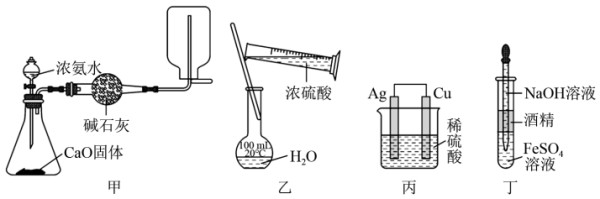
2021-07-13更新 | 667次组卷
纠错 收藏 详情 加入试卷
网址:实验室根据“侯氏制碱法”原理制备少量NaHCO3:NH3+CO2+H2O+NaCl=NaHCO3↓+NH4Cl。其实验包括制取氨气→制取NaHCO3→分离NaH https://www.yuejiaxmz.com/news/view/214250
相关内容
下列是生活中常见物质的pH,其中碱性最强的是( )A.厕所清洁剂pH=1二氧化碳的回收利用是环保和能源领域研究的热点课题.(1)新的研究表明.利用太阳能可以将CO2分解制取炭黑.其原理如右图所示.该过程的能量转化形式为 .在整个过程中.FeO的作用是 .已知:①2Fe2O4 ΔH=akJ/mol②C ΔH=bKJ/mol 则过程2的热化学方程式为 .(2)一定温度下.在密闭容器中进行反应CO22CO ΔH>0 题目和参考答案——青夏教育精英家教网——
我国科学家侯德榜创造了一种著名的纯碱生产方法
[题目]“84消毒液 广泛应用于杀菌消毒.其有效成分是NaClO.实验小组制备消毒液.并利用其性质探索制备碘水的方法.资料:i.HClO的电离常数为Ka=4.7×10
小苏打在日常生活中有广泛的用途.工业上制取小苏打有多种方法.其中有一种是气相固碳法.其利用的原理是:Na2CO3+H2O+CO2=2NaHCO3资料1:NaHCO3+NaOH=Na2CO3+H2O资料2:碳酸钠和碳酸氢钠的溶解度表温度/℃0152030405060碳酸氢钠溶解度/g6.98.729.611.112.714.4516.4碳酸钠溶解度/g7.713.2521.839.74 题目和参考答案——青夏教育精英家教网——
利用CO2和CH4重整可制合成气(主要成分为CO.H2).已知重整过程中部分反应的热化学方程式为:①CH4+2H2(g)△H=+75.0KJ•mol
下列各组物质能在pH=1的无色溶液中大量共存的是( ) A.K2SO4
甲烷作为一种新能源在化学领域应用广泛.请回答下列问题:(1)甲烷
已知:在氢氧化钠浓溶液中加入氧化钙.加热.制成的白色固体就是碱石灰.有两个实验小组的同学决定通过实验探究碱石灰的组成.(1)第一小组设计方案的流程如下:①写出n (OH
漂白粉在社会生活.工业生产中用途广泛.它除了具有漂白作用外.还能杀菌消毒.(1)漂白粉的主要成分为CaCl2.Ca(ClO)2.工业上制取漂白粉的反应为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O.(2)漂白粉长期暴露在空气中会逐渐失效.写出该过程中发生的化学方程式Ca(ClO)2+CO2+H2O=CaCO3+2HClO.2HCl 题目和参考答案——青夏教育精英家教网——

