1、原子结构
原子由原子核和围绕原子核旋转的电子构成。如果将原子比作一棒球场,那么原子核大大小不比一个棒球大,但原子的所有重量都集中在原子核上,而电子只相当于棒球场上的苍蝇,所占空间相比来说也是极小的。原子核带正电荷,电子带负电荷。原子内正电荷和负电荷数量相等,所以原子整体是中性的。电子围绕原子核运动,和地球围绕太阳远行相似。在核的引力作用下,电子分成几层(又叫能带 energy band)按完全确定的轨道运行,而且各层所能容纳的电子数目也有一定规律。以硅元素为例,原子核周围的14个电子组成三层环,围绕原子核运动。从里往外数,第一层环上有其2个电子,其余依次为8、4个电子。凡是环上的电子数为2、8、18时.这些环上的电子总是比较稳定的,这类元素一般形成绝缘体。若环上的电子数不等于以上各数时,这些环上的电子总是不太稳定。于最外层的价电子离核比较远,所受引力最小,所以最容易受外界影响而形成自由电子。导体和半导体都是靠最外层的自由电子进行导电的。
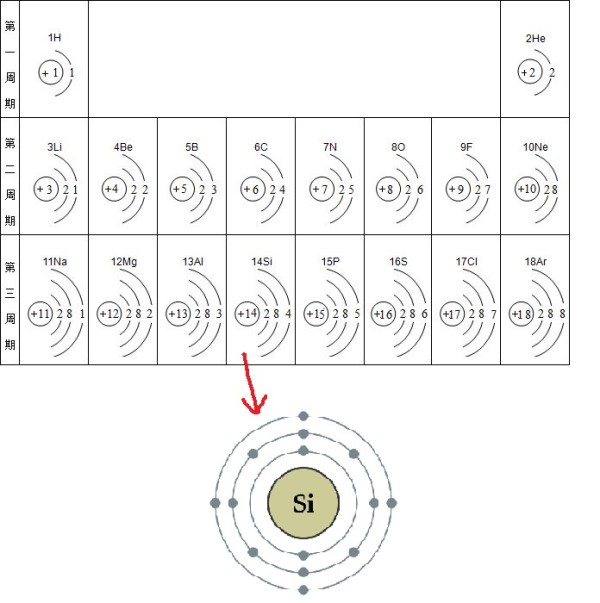
而每个原子核除了吸引自己的价电子外,还吸引相邻原子的价电子。因此

 众里寻佳千百度1995 于 2020-10-13 19:53:58 发布
众里寻佳千百度1995 于 2020-10-13 19:53:58 发布
