钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2).含有少量MgO.CaO.SiO2等杂质.利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示: 已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl
学习电池分类: 根据电池类型(铅酸、锂离子等)正确处理 #生活技巧# #环保生活小窍门# #电子垃圾回收#
钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、CaO、SiO2等杂质。利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示: 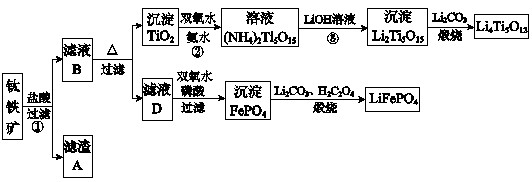
已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O
(1)化合物FeTiO3中铁元素的化合价是 。
(2)滤渣A的成分是 。
(3)滤液B中TiOCl42- 转化生成TiO2的离子方程式是 。
(4)反应②中固体TiO2转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如下图所示。反应温度过高时,Ti元素浸出率下降的原因是 。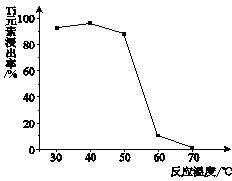
(5)反应③的化学方程式是 。
(6)由滤液D制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(7)若采用钛酸锂(Li4Ti5O12)和磷酸亚铁锂(LiFePO4)作电极组成电池,其工作原理为:Li4Ti5O12+3LiFePO4Li7Ti5O12+3FePO4
该电池充电时阳极反应式是 。
(12分,每空2分)
(1)+2
(2)SiO2
(3)TiOCl42-+H2O TiO2↓+2H++4Cl-
(4)温度过高时,反应物氨水(或双氧水)受热易分解
(5) (NH4)2Ti5O15+2LiOH=Li2Ti5O15↓+2NH3·H2O(或2NH3+2H2O)
(6)20/9(1分)
(7)LiFePO4 – e-=FePO4+Li+(1分)
解析试题分析:(1)根据题目所给信息:可表示为FeO·TiO2,可知Fe的化合价为:+2。
(2)FeTiO3、MgO、CaO与HCl反应,剩下的固体只有SiO2。
(3)过滤后未加其他反应物,所以TiOCl42-与H2O反应,生成TiO2,同时生成H+、Cl?。
(4)TiOCl42- 转化为TiO2时,需要加入反应物双氧水、氨水,这两种物质受热易分解。
(5)(NH4)2Ti5O15为铵盐,LiOH为强碱,发生复分解反应,根据反应规律,即可写出化学方程式。
(6)分析反应流程,H2O2把Fe2+氧化为Fe3+,H2C2O4把Fe3+还原为Fe2+,H2O2中O由-1价变为-2价,H2C2O4由+3价变为+4价,根据电子转移总数相等得:m(H2O2)×17÷200g/mol×2=m(H2C2O4)÷90g/mol×2,得m(H2O2):m(H2C2O4)= 20/9。
(7)电池充电时阳极反应为失电子反应,LiFePO4中Fe失去1个电子,由+2价变为+3价,生成FePO4,同时得到Li+。
考点:本题考查化学工艺流程图的分析,化合价的判断、化学方程式及离子方程式的书写、有关氧化还原反应的计算。
练习册系列答案
相关习题
科目:高中化学来源:题型:单选题
下列关于化学与生产、生活的认识错误的是
A.可利用废油脂制肥皂 B.水玻璃可用于制造木材防火剂 C.煤经气化和液化的物理变化可变为清洁燃料 D.铁或铝制成的槽车可以密封贮运浓硫酸或浓硝酸查看答案和解析>>
科目:高中化学来源:题型:填空题
工业上用白云石制备高纯氧化镁的工艺流程如下:
已知白云石的主要成分可表示为:
CaO 32.50%;MgO 20.58%;Fe2O3 2.18%;SiO2 0.96%;其他 43.78%
(1)为了提高白云石的煅烧效果,可以采取的措施是 。
若在实验室中煅烧白云石,需要的仪器除酒精灯、三脚架以外,还需要 。
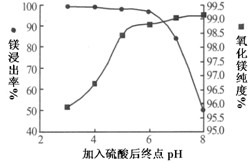
(2)加入H2SO4控制pH时,终点pH对产品的影响如图所示,pH过高会导致镁浸率降低,其原因为
,pH过低对产品影响是
。
(3)从溶液中获得CaSO4·2H2O的操作是蒸发浓缩、
、过滤、洗涤、干燥。
(4)写出沉淀反应中的离子方程式:
。检验沉淀是否洗净的方法是:
。
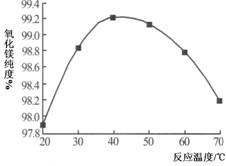
(5)沉淀反应过程中,温度对产品的纯度也有一定的影响。如图为反应温度对氧化镁纯度的影响。最终确定本反应的适宜温度为
。
查看答案和解析>>
科目:高中化学来源:题型:填空题
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下: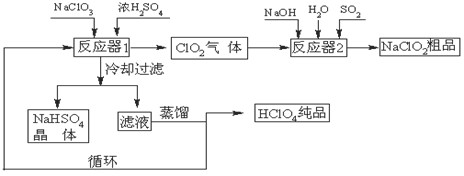
(1)冷却过滤的目的是降低NaHSO4的 ,并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 ,SO2的
作用是作 剂。
(3)上述工业生产高氯酸的化学反应为:3NaClO3+3H2SO4(浓)=3NaHSO4+HClO4+2ClO2+H2O,氧化产物与还原产物的物质的量之比为 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是高氯酸的沸点比较 (填“高”或“低”),容易从溶液中逸出,循环使用的物质是 。
查看答案和解析>>
科目:高中化学来源:题型:填空题
氮化硅( Si3N4)是一种优良的高温结构陶瓷,在工业生产和科技领域有重要用途.
I.工业上有多种方法来制备氮化硅,常见的方法有:
方法一:直接氮化法:在1300℃-1400℃时,高纯粉状硅与纯氮气化合,其反应方程式为
。
方法二:化学气相沉积法:在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HC1,与方法一相比,用此法制得的氮化硅纯度较高,其原因是 .
方法三:Si(NH2)4热分解法:先用四氯化硅与氨气反应生成Si(NH2)4和一种气体(填分子式)________;然后使Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
II.工业上制取高纯硅和四氯化硅的生产流程如下: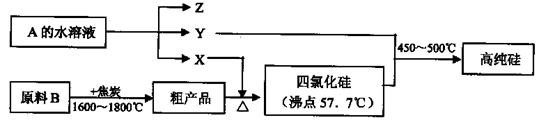
已知:X、高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色.
(1)原料B的主要成分是(写名称) 。
(2)写出焦炭与原料B中的主要成分反应的化学方程式: 。
(3)上述生产流程中电解A的水溶液时,阳极材料能否用Cu (填“能”或“不能”),写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式:
阳极: ;阴极: 。
查看答案和解析>>
科目:高中化学来源:题型:填空题
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、A12O3、SiO2等)制备铬黄的工艺流程如下: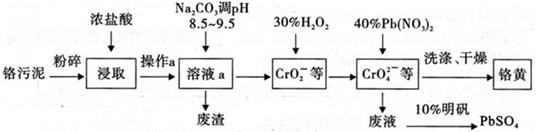
(1)将铬污泥粉碎的目的是 ,操作a的名称为 ;
(2)废渣的主要成分是A1(OH)3和Fe(OH)3。已知25℃时,A1(OH)3的Ksp=1.3×10-33,则该温度下反应Al3++3H2OAl(OH)3+3H+的平衡常数为 (保留两位有效数字);
(3)写出加入30%H2O2过程中发生的离子反应方程式: ;
(4)实验室洗涤铬黄沉淀的方法: ;
(5)写出浓盐酸与A12O3反应的离子方程式: 。
查看答案和解析>>
科目:高中化学来源:题型:计算题
锶(Sr)为第五周期第II A族元素。高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,用工业碳酸锶粉末(含少量钡、铁的化合物等杂质)制备高纯六水氯化锶晶体的过程如下图所示。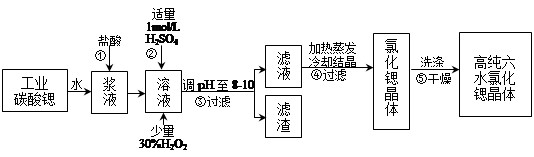
已知:SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。请回答:
(1)操作①加快反应速率的措施有 (任写一种方法)。碳酸锶与盐酸反应的离子方程式为 。
(2)加入少量30% H2O2溶液的发生反应的离子方程式为 。
(3)步骤③中调节溶液pH至8—10,宜选用的试剂为_______(填序号):
A.氨水 B.氢氧化钠 C. 氢氧化锶粉末 D.碳酸钠晶体
所得滤渣的主要成分是Fe(OH)3和 (填化学式)。
(4)工业上用热风吹干六水氯化锶,选择的适宜温度范围是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
(5)若滤液中Ba2+ 浓度为1×10-5mol/L,依下表数据推算出滤液中Sr2+物质的量浓度不大于 mol/L。
SrSO4
BaSO4
Sr(OH)2
Ksp
3.3×10—7
1.1×10—10
3.2×10—4
查看答案和解析>>
科目:高中化学来源:题型:单选题
某地筹建中的“生态农业科技园区”,不仅是农业高新技术示范和推广基地,也将是一个观光休闲的生态农业园区。在一些生产思路上你认为不妥当的是 ( )。
A.将农家肥与化肥综合使用,以提高增产效益B.对大棚中的植物施加适量的CO2,以促进其光合作用C.种植、养殖、制沼气相结合,既可改善环境又可提高农畜牧业的产量D.将硝酸铵和熟石灰混合使用,在给作物提供营养元素的同时,又能降低土壤的酸性查看答案和解析>>
科目:高中化学来源:题型:单选题
下列化学工业有关设备、原料、反应条件配套的是 ( )
A.联合制碱法制纯碱:吸氨塔、碳酸塔、食盐、二氧化碳、氨、30 ℃~35 ℃的氨化饱和食盐水吸收CO2B.接触法制硫酸:氧化炉、硫铁矿、V2O5、4000~5000 ℃C.合成氨:沸腾炉、焦炭、铁触媒、500 ℃D.氨氧化法制硝酸:合成塔、空气、铂铑合金、8000 ℃查看答案和解析>>
网址:钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2).含有少量MgO.CaO.SiO2等杂质.利用钛铁矿制备锂离子电池电极材料(钛酸锂Li4Ti5O12和磷酸亚铁锂LiFePO4)的工业流程如下图所示: 已知:FeTiO3与盐酸反应的离子方程式为:FeTiO3+4H++4Cl https://www.yuejiaxmz.com/news/view/714125
相关内容
LiFePO4锂离子动力电池是奥运会绿色能源.该电池放电时的电极反应式为:正极 FePO4+Li++e磷酸铁锂电池为何一到冬天就“胯了”?【钜大锂电】
新型锂离子电池在新能源的开发中占有重要地位,可用作节能环保电动汽车的动力电池。磷酸亚铁锂(LiFePO4)新型锂离子电池的首选电极材料,它的制备方法如下:方法一:将碳酸锂、
磷酸铁锂电池是如何维护的【钜大锂电】
三元锂+磷酸铁锂=三元铁锂?电池包还能玩混搭?
朱美芳院士/徐桂银团队: 实验室到工业化回收磷酸铁锂正极材料
格林美:公司回收再造的碳酸锂为电池级碳酸锂,碳酸锂的纯度超过99.6%,杂质含量低于行标电碳
锂电池回收再利用
比亚迪75ah高倍率磷酸铁锂电池模组 比亚迪75ah 3.2V磷酸铁锂电池模组,高倍率放电,为你的设备提供稳定电力! 模组组合灵活,有一并6
钛行业资料整理 一、钛行业概述1. 钛的基本性质和用途概述钛在元素周期表中位于第IVB 族,元素符号Ti,原子序数22,属于难熔稀有轻金...

