对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g).下列叙述正确的是( ) A.达到化学平衡时.4v正(O2)=5v逆(NO) B.若单位时间内生成xmolNO的同时消耗xmolNH3.则反应达到平衡状态 C.化学平衡时.若增加容器体积.则正反应速率减小.逆反应速率增大 D.化学反应速率关系是:2v正(NH3)=3v正(H2O) 题目和参考答案——青夏教育精英家教网——
[教育] 怎样正确引导孩子的逆反心理 #生活知识# #教育子女#
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是( ) A.达到化学平衡时,4v正(O2)=5v逆(NO)
B.若单位时间内生成xmolNO的同时消耗xmolNH3,则反应达到平衡状态
C.化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.化学反应速率关系是:2v正(NH3)=3v正(H2O)
练习册系列答案

更多初中、高中辅导课程推荐,点击进入>>
相关习题
科目:高中化学来源:题型:
发射卫星时可用肼(N2H4)为燃料和二氧化氮做氧化剂,两者反应生成氮气和气态水.
已知;N2(g)+2O2(g)=2NO2(g)△H=67.7kJ•mol﹣1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣543kJ•mol﹣1
H2(g)+F2(g)=HF(g)△H=﹣269kJ•mol﹣1
H2(g)+O2(g)=H2O(g)△H=﹣242kJ•mol﹣1
(1)肼和二氧化氮反应的热化学方程式为
(2)有人认为若用氟代替二氧化氮作氧化剂,则反应释放能量更大,肼和氟反应的热化学方程式为 .
查看答案和解析>>
科目:高中化学来源:题型:
保护环境是每一个公民的责任,下列做法有利于保护环境的是( )
①推广使用无磷洗涤剂 ②城市生活垃圾分类处理 ③推广使用一次性木质筷子 ④推广使用清洁能源 ⑤过量使用化肥、农药 ⑥推广使用无氟冰箱.
A. ①②④⑤ B. ②③④⑥ C. ①②④⑥ D. ③④⑤⑥
查看答案和解析>>
科目:高中化学来源:题型:
下列图中的实验方案,能达到实验目的是()
A B C D
实验
方案 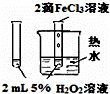
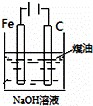
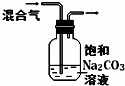
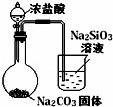
实验
目的 验证FeCl3对H2O2分解反应有催化作用 制备Fe(OH)2并能较长时间观察其颜色 除去CO2气体中混有的SO2 比较HCl、H2CO3和H2SiO3的酸性强弱
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学来源:题型:
某同学在实验室从如图I标签的试剂瓶中取少许钠进行燃烧实验,实验后发现还有少许黑色固体生成.从反应物及实验操作猜测:该黑色物质可能为炭与另一种氧化物组成的混合物.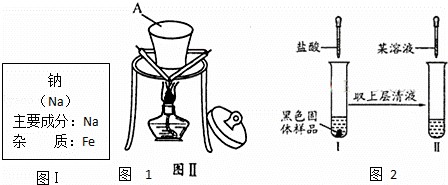
根据题意和图示回答下面问题:
(1)装置图Ⅱ中A的名称
(2)此氧化物可能是FeO或 (写化学式)
(3)对黑色固体物质的组成作如图所示探究
①实验I加入盐酸溶液的目的是 ;
②仅通过实验Ⅱ,用最简步骤能快速确定
黑色氧化物的组成,请完善该设计.(限选试剂:稀盐酸、KSCN溶液、10%H2O2 溶液)
实验操作 预期现象与结论 相关离子方程式
取少量实验Ⅰ中的澄清溶液,加入试剂 . .
.
查看答案和解析>>
科目:高中化学来源:题型:
下列能用勒夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
科目:高中化学来源:题型:
已知反应mX(g)+nY(g)qZ(g)的ΔH<0,m+n>q,在恒容密闭容器中反应达到平衡时,下列说法正确的是( )
A.通入稀有气体使压强增大,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学来源:题型:
下列实验描述,符合事实的是( )
A.
金属钠暴露在空气中,表面变暗,生成淡黄色固体氧化钠
B.
用坩埚钳夹住打磨过的镁带,在酒精灯上点燃,发出耀眼白光,放出大量的热,产生白色固体
C.
用坩埚钳夹住铝箔在酒精灯上点燃,发出耀眼的白光,放出大量的热
D.
用坩埚钳夹住铝箔在酒精灯上加热至熔化,轻轻晃动,有液态的铝滴落下来
查看答案和解析>>
科目:高中化学来源:题型:
下面关于化学反应的限度的叙述中,正确的是( )
A. 化学反应的限度都相同
B. 可以通过改变温度控制化学反应的限度
C. 可以通过延长化学反应的时间改变化学反应的限度
D. 当一个化学反应在一定条件下达到限度时,反应即停止
查看答案和解析>>
网址:对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g).下列叙述正确的是( ) A.达到化学平衡时.4v正(O2)=5v逆(NO) B.若单位时间内生成xmolNO的同时消耗xmolNH3.则反应达到平衡状态 C.化学平衡时.若增加容器体积.则正反应速率减小.逆反应速率增大 D.化学反应速率关系是:2v正(NH3)=3v正(H2O) 题目和参考答案——青夏教育精英家教网—— https://www.yuejiaxmz.com/news/view/1345594
相关内容
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)已知:反应ⅠN2(g)+O2(g)=2NO(g)ΔH=akJ·mol-1反应Ⅱ2NO(g)+O2低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数.投料比及热值等问题.已知:CO(g) + H2O(g)H2(g) + CO2(g) △H= a kJ·mol
含氮化合物对人类生活有十分重大的意义.(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.已知:N2(g)+O2△H=+180.5kJ/mol4NH3(g)+5O2+6H2O(g)△H=
可逆反应2SO2+O22SO3.正反应速率分别用v(SO2).v(O2).v(SO3)(mol·L
研究碳、氮及其化合物的转化对于环境的改善有重大意义。(1)氧化还原法消除NOx的转化如下:NONO2N2已知:NO(g)+O3(g)===NO2(g)+O2(g
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
在一定条件下.二氧化硫和氧气发生如下反应:2SO2(g)+O2(g)?2SO3(1)写出该反应的化学平衡常数表达式 K= (2)降低温度.该反应K值 .二氧化硫转化率 .化学反应速率 (以上均填增大.减小或不变)(3)600℃时.在一密闭容器中.将二氧化硫和氧气混合.反应过程中SO2.O2.SO3物质的量变化如图.反应处于平衡状态的时间是 .(4)� 题目和参考答案——青夏教育精英家教网——
I.在某体积为2L的密闭容器中充入1.5mol NO2和2mol CO.一定条件下发生反应:NO2+CO===CO2+NO.2 min时.测得容器中NO的物质的量为0.5 mol . ①该段时间内.用CO2表示的平均反应速率为 ②2 min时.容器内气体的总物质的量为 . ③假设此反应在5 min时达到平衡.则此时容器内气体的总物质的量 (填“大于 .“小于 或“等于 题目和参考答案——青夏教育精英家教网——
肼是一种高效清洁的火箭燃料.0.25 mol N2H4(g)完全燃烧生成氮气和气态水时.放出133.5 kJ热量.则下列热化学方程式中正确的是A. N2H4(g)+O2(g)===N2 ΔH=+267 kJ·mol

