研究碳、氮及其化合物的转化对于环境的改善有重大意义。(1)氧化还原法消除NOx的转化如下:NONO2N2已知:NO(g)+O3(g)===NO2(g)+O2(g
汽车尾气处理主要是通过安装催化转化器,将有害的一氧化碳、氮氧化物转化为无害的二氧化碳和氮气。 #生活常识# #环保节能技巧# #汽车尾气处理#
题型:解答题-原理综合题 难度:0.65 引用次数:295 题号:7491835
研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO NO2N2
NO2N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为
。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?
(填“能”或“否”),依据是
_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因
。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈
(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为
_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
①该反应的正反应为
________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将
(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为
。
更新时间:2019/01/16 11:45:56 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐解答题-原理综合题 | 适中 (0.65)
解题方法
【推荐1】科研工作者积极展开水煤气和氨气应用的研究,这些物质对新能源发展有着重要意义。
Ⅰ.工业上可以利用水煤气合成甲醇:CO(g)+2H2(g) ⇌CH3OH(g)。一定条件下,向密闭容器中通入2molCO和4molH2,发生上述反应。
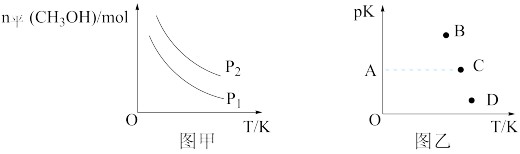
(1)图甲中,压强P1
___P2(填“>”“<”或“=”)。
(2)图乙中,能正确反映A状态随温度升高pK(pK=-lgK)数值变化的点是
。
(3)该反应的正逆反应速率表达式分别为v正=k正c(CO)c2(H2),v逆=k逆c(CH3OH),k正、k逆为反应速率常数。在一定条件下,加入催化剂,反应速率常数将
(填“增大”、“减小”或“不变”,下同);其它条件不变时,降低温度,的值将
____。
Ⅱ.水煤气的变换反应:CO(g)+H2O(g) ⇌CO2(g)+H2(g)
(4)在标准压强和指定温度下,由元素最稳定的单质生成1mol化合物时反应热称为该化合物的标准摩尔生成焓,已知CO(g)、CO2(g)、H2(g)的标准摩尔生成焓分别为akJ/mol、bkJ/mol、ckJ/mol,则水煤气变换反应的焓变△H=
。
(5)水煤气变换反应的机理按以下步骤进行:
i.CO(g)+H2O(g) ⇌HCOOH(g)
ii.HCOOH(g) ⇌CO2(g)+H2(g)
在一定温度,100kPa下,将等物质的量的CO和H2O(g)充入2L恒容密闭容器中,达到平衡时测得HCOOH与CO2的压强之比为1∶3,CO的转化率为40%,则反应i的平衡常数Kp=
(kPa-1)。(用平衡分压代替平衡浓度也可求出平衡常数Kp,某组分分压=总压×物质的量分数。)
Ⅲ.以铁为催化剂、400~500℃、10~30MPa的条件下氮气和氢气可以直接合成氨,反应历程如下(*表示吸附态):①化学吸附:N2(g)→2N*,H2(g)→2H*,速率慢
②表面反应:N*+H*⇌NH*,NH*+H*⇌NH2*,NH2*+H*⇌NH3*,速率快
③脱附:NH3*⇌NH3(g),速率快
(6)下列关于合成氨的叙述正确的是
。(填字母)
A.合成氨的总反应为N2+3H2 2NH3
2NH3
B.反应历程的三步中步骤①活化能最小
C.反应控制在400~500℃下进行,是为了保证反应速率和催化剂的活性
D.不断将氨液化移去,利于反应正向进行
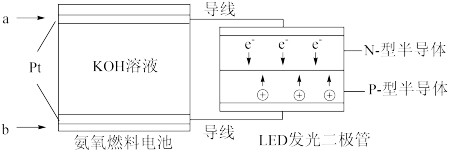
(7)用氨气研发燃料电池装置(如图所示),电池反应为4NH3+3O2=2N2+6H2O,使用1mol/L的KOH溶液作电解质溶液,请写出通入a气体一极的电极反应式
。
2021/05/29 | 268次组卷
解答题-原理综合题 | 适中 (0.65)
名校
解题方法
【推荐2】硫酸是一种重要的基本化工产品,接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g) SO3(g) △H=-98 kJ·mol-1。
回答下列问题:
(1)已知液态二氧化硫可以发生类似于水自身电离:2SO2(l)SO2++SO。SO2+中的σ键和π键数目之比为
。
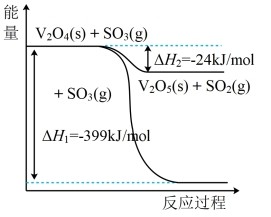
(1)钒催化剂参与反应的能量变化如图所示,V2O5(s)与SO2(g)反应生成VOSO4(s)和V2O4(s)的热化学方程式为
。
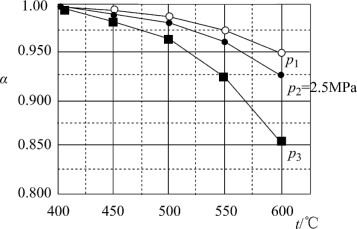
(3)当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5 MPa、2.5 MPa和5.0 MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α=
。
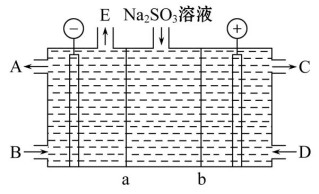
(4)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将得到的Na2SO3进行电解生产硫酸,其中阴、阳膜组合电解装置如图所示,电极材料为石墨。A~E分别代表生产中的原料或产品,b表示
(填“阴”或“阳”)离子交换膜。阳极的电极反应式为
_________。
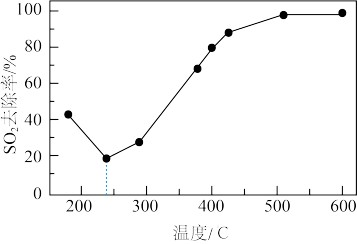
(5)研究在一定条件下,CO可以去除烟气中的SO2,其反应原理如下: 2CO+SO2=2CO2+S其他条件相同,以γ-Al2O3(一种多孔性物质,每克的内表面积高达数百平方米,具有良好的吸附性能)作为催化剂,研究表明,γ-Al2O3在240℃以上发挥催化作用。反应相同的时间,SO2的去除率随反应温度的变化如图所示。240℃以前,随着温度的升高,SO2去除率降低的原因是
。240℃以后,随着温度的升高,SO2去除率迅速增大的主要原因是
__________。
2020/09/15 | 248次组卷
解答题-原理综合题 | 适中 (0.65)
名校
【推荐3】硫元素在自然界中通常以硫化物、硫酸盐或单质的形式存在,其单质和化合物在工农业生产中有着重要的作用。
(1)硫元素在周期表中的位置为
,其最简单气态氢化物的电子式为
_________。
(2)在工业上SO2可以用于制备H2SO4。
已知SO2(g)+O2(g)+H2O(g)=H2SO4(l) △H1=-272.5kJ·mol-1
H2O(g)=H2O(l) △H2=-44kJ·mol-1
SO3(g)+H2O(l)=H2SO4(l) △H3=-130kJ·mol-1
则2SO2(g)+O2(g)=2SO3(g) △H=
kJ·mol-1
(3)某兴趣小组同学探究SO2的还原性,使用的药品和装置如图所示: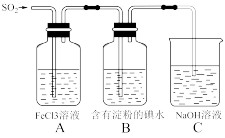
A瓶中发生反应的离子方程式为
。B瓶中出现的现象为
________。若要证明A、B的反应中SO2均显现还原性被氧化为SO42—,可以采取的操作和现象是
_______________________________________。
(4)硫的氧化物排放到大气中会造成空气污染,常温常压下用如图所示传感器可以检测空气中SO2的含量。下列关于该传感器的叙述正确的是
(填序号)。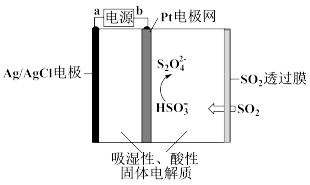
A. a为电源的正极
B. Pt电极网上发生氧化反应
C.当电路中电子转移0.5mol时,进入传感器的SO2为11.2L
D.阴极的电极反应是2HSO3—+2H+-2e—=S2O42—+2H2O
2019/09/27 | 218次组卷
网址:研究碳、氮及其化合物的转化对于环境的改善有重大意义。(1)氧化还原法消除NOx的转化如下:NONO2N2已知:NO(g)+O3(g)===NO2(g)+O2(g https://www.yuejiaxmz.com/news/view/1212841
相关内容
消除含氮化合物对大气和水体的污染是环境保护的重要研究课题。(1)已知:反应ⅠN2(g)+O2(g)=2NO(g)ΔH=akJ·mol-1反应Ⅱ2NO(g)+O2对大气污染物SO2、NOx进行研究具有重要环保意义。请回答下列问题:(1)为减少SO2的排放,常采取的措施是将煤转化为清洁气体燃料。已知:H2(g)+O2(g)=H2O(g)△H=-241.8kJ·mol-1C
利用化学原理对废气、废水进行脱硝、脱碳处理,可实现绿色环保、废物利用,对构建生态文明有重要意义。Ⅰ.脱硝:(1)H2还原法消除氮氧化物已知:N2(g)+2O2(
含氮化合物对人类生活有十分重大的意义.(1)目前广泛使用的工业合成氨方法是用氮气和氢气在一定条件下化合.已知:N2(g)+O2△H=+180.5kJ/mol4NH3(g)+5O2+6H2O(g)△H=
低碳经济呼唤新能源和清洁环保能源.煤化工中常需研究不同温度下的平衡常数.投料比及热值等问题.已知:CO(g) + H2O(g)H2(g) + CO2(g) △H= a kJ·mol
能源.环境与人类生活和社会发展密切相关.研究它们的综合利用有重要意义.(1)氧化
碳及其含碳化合物在人们的生产生活中应用广泛。(1)天然气是人们日常生活中的清洁能源。已知①CH4(g)+2O2(g)=CO2(g)+2H2O(l);△H1=-890.3kJ·mol-1②2CO(g)+O2(g)=2CO2(g);△H2=
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
氢气是一种清洁能源.氢气的制取与储存是氢能源利用领域的研究热点.(1)以甲烷为原料制取氢气是工业上常用的制氢方法.已知:CH4(g)+H2O+3H2(g) ΔH=+206.2 kJ/molCH4——青夏教育精英家教网——
17.氢气(H2)一氧化碳(CO).辛烷(C8H15).甲烷(CH4)的热化学方程式分别为: H2(g)+O2(g)====H2O(1); △H=

