氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:(1)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l)ΔH1O2(g)
燃料电池技术提供清洁的氢能源,可用于汽车和发电 #生活知识# #科技生活# #科技改变生活# #新能源技术#
题型:解答题-原理综合题 难度:0.65 引用次数:193 题号:6134428
氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)氢气可用于制备H2O2。已知:
H2(g)+A(l)=B(l) ΔH1
O2(g)+B(l)=A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+ O2(g)= H2O2(l)的ΔH
0(填“>”、“<”或“=”)。
(2)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是
。
①容器内气体压强保持不变
②吸收y mol H2只需1 mol MHx
③若降温,该反应的平衡常数增大
④若向容器内通入少量氢气,则v(放氢)>v(吸氢)
(3)化工生产的副产物也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH−FeO42−+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42−,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。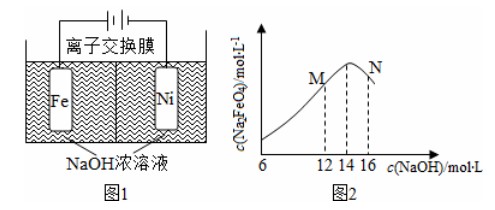
①电解过程中,须将阴极产生的气体及时排出,其原因是
。
②c(Na2FeO4)随初始c(NaOH)的变化如图2,,请分析N点c(Na2FeO4)低于最高值的原因:
。
更新时间:2018/03/05 20:32:27 |
抱歉! 您未登录, 不能查看答案和解析点击登录
相似题推荐解答题-原理综合题 | 适中 (0.65)
名校
2023/10/21 | 122次组卷
解答题-原理综合题 | 适中 (0.65)
解题方法
【推荐2】Cu2O是重要的催化剂和化工原料,工业上制备Cu2O的主要反应如下:
①C(s)+CO2(g)⇌2CO(g) ΔH=+172.5 kJ·mol-1
②CO(g)+2CuO(s) ⇌Cu2O(s)+CO2(g) ΔH=-138.0 kJ·mol-1
(1)C与CuO反应生成Cu2O和CO的热化学方程式为
。
(2)一定温度下,向5L恒容密闭容器中加入1molCO和2 molCuO,发生反应②,5 min时达到平衡,测得容器中CuO的物质的量为0.8mol。
①0~5 min内,用CO2表示的反应速率v(CO2)=
。
②CO的平衡转化率α=
。
(3)向5L密闭容器中加入1molC和1molCO2,发生反应①,CO2、CO的平衡体积分数(φ)与温度(T)的关系如图所示: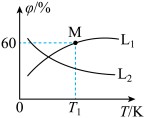
①能表示CO2的平衡体积分数与温度关系的曲线为
(填“L1”或“L2”),理由为
_______。
②温度为T1时,该反应的平衡常数K=
。
2020/01/31 | 51次组卷
解答题-原理综合题 | 适中 (0.65)
解题方法
【推荐3】最近有媒体报道,北极圈有大量甲烷释放出来,由此带来的灾难可能不可估量。但甲烷的合理利用可以给人类带来福利,因为甲烷是重要的燃料和工业原料。回答下列问题:
(1)北极圈冰盖下的甲烷是以“可燃冰”,即甲烷水合物(CH4·nH2O)形式存在,常温常压下,“可燃冰”能发生分解反应,化学方程式为
。
(2)利用甲烷的还原性,可以对大气中的氮氧化物进行处理。已知一定条件下:
①
②
则
,该反应
_______(填“能”或“不能”)自发进行。
(3)利用CH4可制备合成气,反应为。一定条件下,在某密闭容器中通入2 mol CH4(g)、2 mol H2O(g),达到平衡时,测得混合气体中CH4的体积分数与温度、压强(其中p1=0.1 MPa)的关系如图1所示: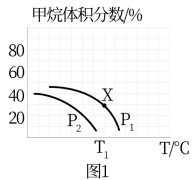
①a
(填“>”或“<”)0,p2
_______(填“>”或“<”)p1。
②压强为p1,温度为T1 ℃条件下,5 min时反应达到平衡状态,则0~5 min内的平均反应速率(H2)=
mol/min,用分压表示的平衡常数Kp=
______(MPa)2。
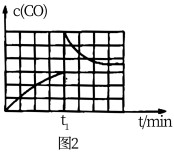
③时间t1时,改变某种条件,反应过程中CO浓度的变化曲线如图2所示,则t1时改变的条件可能是
。
④若该反应在T1 ℃、容积固定的密闭容器中进行,则下列能判断该反应达到平衡状态的是
。
A 容器中CH4的浓度和CO的浓度相等
B 断裂2 mol H—O键的同时断裂3 mol H—H键
C 正(H2O)=3逆(H2)
D 混合气体的平均分子质量不再改变
2020/09/14 | 64次组卷
网址:氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:(1)氢气可用于制备H2O2。已知:H2(g)+A(l)=B(l)ΔH1O2(g) https://www.yuejiaxmz.com/news/view/1359725
相关内容
过氧化氢(H2O2)是重要的化工产品,广泛应用于绿色化学合成、医疗消毒等领域。回答下列问题:(1)已知:H2(g)+12O2(g)=H2O(l)△H1=氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。Ⅰ.制取氢气(1)甲醇和水蒸气制取氢气的过程中有下列反应:CH3OH(g)⇌CO(g)+2H2(
随着化石能源的减少.新能源的开发利用日益迫切.(1)Bunsen热化学循环制氢工艺由下列三个反应组成:SO2(g)+I2(g)+2H2O+H2SO4(l)△H=a kJ?mol
甲醇是人们开发和利用的一种新能源.已知:①2H2(g)+O2(g)═2H2O(l)△H1=
开发、使用清洁能源发展“低碳经济”,正成为科学家研究的主要课题.氢气、甲醇是优质的清洁燃料,可制作燃料电池.(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1=
氢气是一种清洁能源.氢气的制取与储存是氢能源利用领域的研究热点.(1)以甲烷为原料制取氢气是工业上常用的制氢方法.已知:CH4(g)+H2O+3H2(g) ΔH=+206.2 kJ/molCH4——青夏教育精英家教网——
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知:CH4(g)+H2O(g)=“===”CO(g)+3H2(g)H=“+206.2”kJ·mol
氢气是一种清洁高效能源,以甲醇为原料可以制取氢气。回答下列问题:(1)甲醇水蒸气重整制氢主反应:①CH3OH(g)CO(g)+2H2(g)ΔH=+90.7kJ/
开发使用清洁能源.发展“低碳经济 正成为科学家研究的主要课题.氢气.甲醇是优质的清洁燃料.可制作燃料电池.(1)甲烷水蒸气转化法制H2的主要转化反应如下:CH4(g) + H2O(g) CO(g) + 3H2(g)? △H=+206.2 kJ·mol
科学家预测“氢能”将是未来最理想的新能源。请回答下列问题:(1)实验测得,1g氢气燃烧生成液态水放出142.9kJ热量,则表示氢气燃烧热的热化学方程式为

